重磅发布!新英格兰杂志公布首个体内 CRISPR 基因编辑治疗人类遗传疾病试验结果
- 2022-07-04 18:00:11 健康一线
- 健康
2021年6月26日,国际顶尖医学期刊《新英格兰医学杂志》(NEJM)在线刊登了题为“CRISPR-Cas9 In Vivo Gene Editing for Transthyretin Amyloidosis”的文章,这是首个体内 CRISPR 基因编辑疗法的临床试验结果,大大扩展了 CRISPR 基因编辑疗法的应用范围,直接注射 CRISPR 组份即可在体内进行高效基因编辑,为许多遗传疾病的治疗开辟了新的途径,被誉为“开启了医学新时代”。此研究由伦敦大学国家淀粉样变性中心、伦敦圣乔治大学、皇家自由学院、奥克兰大学和新西兰临床研究等团队共同完成,并由Intellia Therapeutics和Regeneron联合赞助。
CRISPR-Cas9基因编辑技术
CRISPR-Cas9最早在细菌和古细菌中被发现,是细菌长期演化过程中形成的一种适应性免疫防御机制,用来对抗入侵的病毒及外源DNA。科学家利用CRISPR-Cas9基因编辑技术对靶基因进行特定DNA修饰,在血液病、肿瘤和其他遗传性疾病等涉及基因治疗的应用领域取得了重大进展。通过Cas9酶发现、剪切并取代DNA的特定序列, CRISPR-Cas9基因编辑可以对患者的染色体进行永久、精确的改变,并修复潜在的基因突变,治愈任何具有遗传起源的疾病,因此也被誉为生物学领域的“规则改变者”。
本研究主要结果
遗传性转甲状腺素淀粉样变性(hATTR)是一种罕见的常染色体显性遗传疾病,是由转甲状腺素蛋白(TTR)基因突变,蛋白产物错误折叠,形成淀粉样纤维在组织中积聚,造成心脏、神经系统等多种组织严重并发症。本研究选择hATTR患者作为受试者,主要是基于以下三个原因。第一,hATTR是一种单基因遗传病。第二,敲除TTR对受试者产生的生理影响很有限。第三,体内循环TTR几乎全部来自肝脏(>99%),而且针对肝脏的脂质纳米靶向系统已经成功开发。
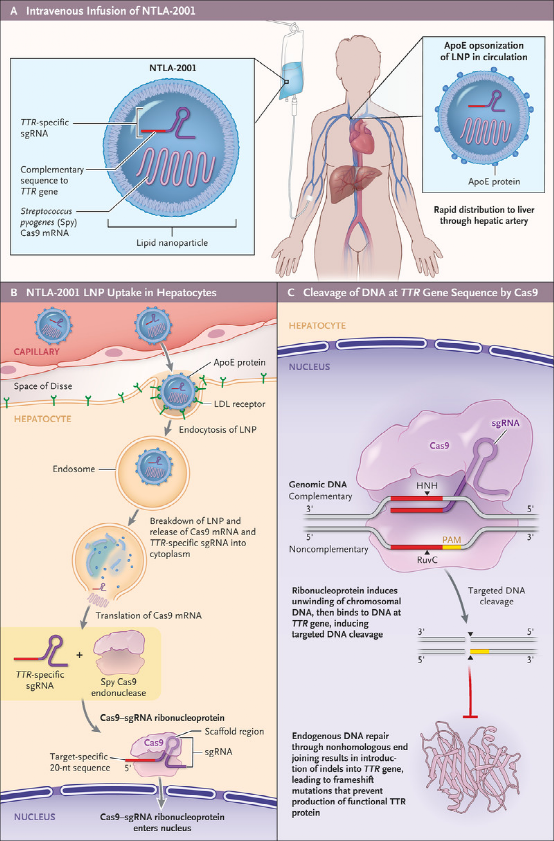
本项研究采用的NTLA-2001疗法正是基于CRISPR-Cas9技术,由一种具有肝细胞靶向性的脂质纳米颗粒(LNP)递送系统组成。NTLA-2001可以特异性沉默肝细胞中TTR基因,单次给药后可降低野生型和突变型TTR蛋白的表达,具有潜在治愈ATTR的能力。
NTLA-2001的作用机制
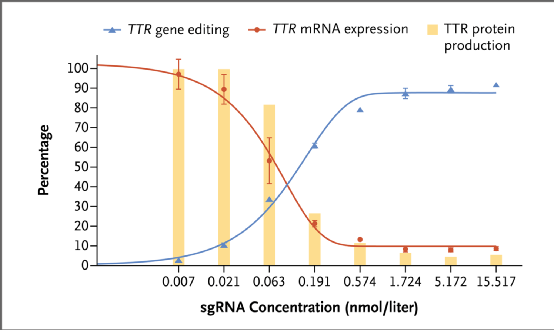
研究者首先在人原代干细胞中进行体外实验,证实NTLA-2001能使TTR mRNA表达减少≥91%,TTR蛋白生成量减少≥95%。测序数据也表明NTLA-2001成功诱导了TTR敲除。
NTLA-2001效力的体外评估
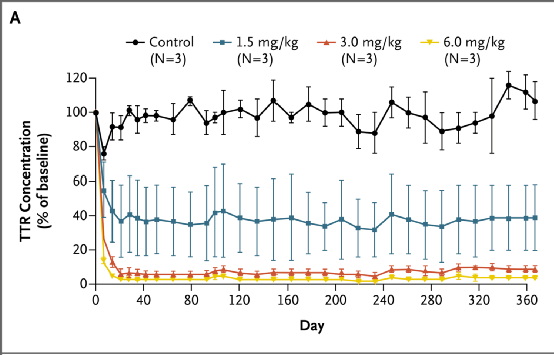
在小鼠和食蟹猴中进行的临床前研究显示, NTLA-2001或其替代物Cyn-LNP单次给药可实现持久TTR编辑和血清TTR蛋白表达近乎完全消除,且无不良反应。基于这些安全性数据,推算出人体未观察到不良效应的水平为0.1mg/kg。
Cyn-LNP(用于非人灵长类动物的NTLA-2001替代物)的体内药理学特征
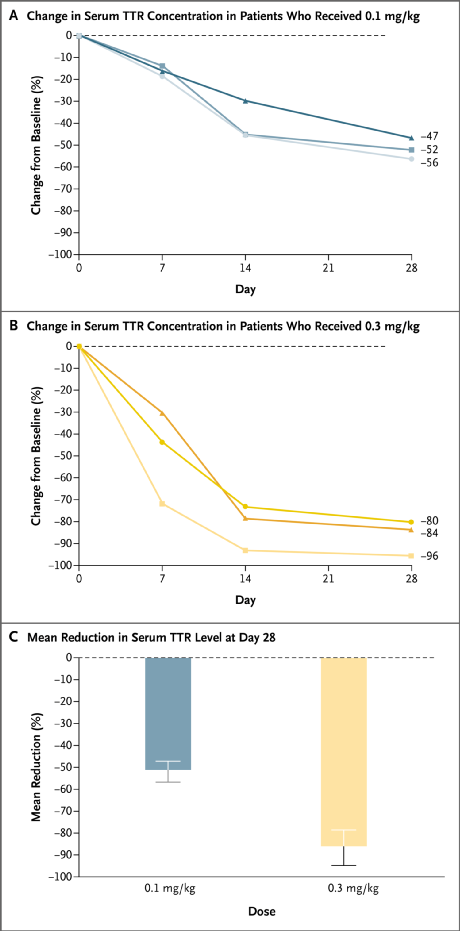
基于以上研究,本项1期临床试验纳入6名hATTR多发性神经病患者,3例患者接受0.1 mg/kg单剂NTLA-2001治疗,3例接受0.3 mg/kg单剂NTLA-2001治疗。研究人员将血清TTR浓度水平作为判断NTLA-2001的药效的指标。
结果显示,总体上NTLA-2001可使患者血清TTR呈剂量依赖性降低,大剂量组的TTR浓度降幅更大。具体地,治疗后第28天,0.1 mg/kg组的TTR平均降幅为52%,0.3 mg/kg组的降幅为87%,其中一名患者TTR水平下降达96%。相比之下,治疗ATTR多发性神经病患者的标准疗法通常的TTR降低幅度约80%,但患者需要长期接受治疗。此外,在各剂量组患者中观察到的NTLA-2001效应均可重现。
人体输入NTLA-2001后血清TTR蛋白浓度相对于基线的降幅
本研究是一项分为两部分的全球性、1期、开放标签、多中心研究,此次发表的结果是该试验第1部分最初两个剂量组的数据,试验仍在进行中。令人兴奋的是,用于NTLA-2001的CRISPR-Cas9方法已经模块化,只需要替换sgRNA就可以用来治疗其他疾病。目前以CRISPR基因编辑技术作为基因治疗方式的产品研发涵盖了血液疾病、实体肿瘤、罕见病和再生医学等领域,值得期待。
CRISPR基因编辑体内外治疗现状
根据基因编辑过程发生在处体内或体外,CRISPR可分为体外基因编辑和体内基因编辑两种方式。
体外基因编辑过程发生在体外,在对取自患者的细胞进行基因编辑后,再重新输回患者体内,基本思路类似于肿瘤免疫治疗的CAR-T疗法。目前这类研究在血液性疾病中取得了重要进展,并尝试应用于实体瘤的治疗。
2016年8月,四川大学华西医院卢铀教授团队开展了全球首例对人体使用CRISPR治疗肺癌的试验。2019年4月,丹娜—法伯/波士顿儿童医院癌症和血液病联合中心以及麻省大学医学院的研究人员在Nature Medicine发表论文,将CRISPR-Cas9基因编辑应用于镰状细胞贫血和β-地中海贫血患者自身的血液干细胞,可更高效地对血液干细胞进行编辑。基因编辑公司CRISPR Therapeutics也于次年12月发布了针对患有输血依赖性β-地中海贫血的临床试验结果,入组患者治疗效果三年内安全且有效,成功率接近100%。
体内基因编辑则是利用载体将CRISPR/Cas直接递送至靶向部位,在人体内直接改造病变基因。本项研究是世界首例支持体内CRISPR基因编辑安全性和效果的临床数据,结果表明单次静脉注射CRISPR可精确编辑体内的靶细胞,治疗基因疾病,具有里程碑意义。
CRISPR存在的问题
对于体外基因编辑,研发人员可以识别脱靶细胞与正常细胞从而避免无效或错误编辑,安全性更高,所以相应地体外临床试验进展较快。然而,体内基因编辑直接靶向组织和器官,用于治疗人类疾病时则必须要 解决“脱靶效应”的问题,即如果CRISPR系统对体内靶基因以外的DNA序列进行了编辑,则可能引入基因变异,带来潜在的未知风险。尽管本次公布实验结果显示,研究人员使用原代人类肝细胞评估治疗剂量的NTLA-2001并未产生“脱靶效应”,但我们对该技术的安全风险及相关机制的认识仍然非常有限,因此在CRISPR基因编辑技术的安全性评估上还需谨慎。另一个值得关注的问题是,CRISPR基因编辑这把“上帝之刀”还必须解决伦理、道德方面的冲突。
参考资料
1.Gillmore JD, Gane E, Taubel J, et al. CRISPR-Cas9 In Vivo Gene Editing for Transthyretin Amyloidosis. N Engl J Med. 2021;385(6):493-502. doi:10.1056/NEJMoa2107454
本文地址://www.styjt.com/jiankang/2022-07-04/597487.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- 河北上半年投入省以上资金201亿元支持交通运输基础设施建设2022-07-04 18:00:12
- 江苏无锡市民乘高铁离锡须持48小时内核酸阴性证明2022-07-04 18:00:11
- 助力打拐!公安部公布全国5000余个免费采血点信息2022-07-04 18:00:11
- 我国大豆育种花粉低温保存关键技术取得新突破2022-07-04 18:00:11
- Jennifer Doudna最新研究:基于CRISPR的新型RNA敲低工具问世,效率更高、脱靶更低2022-07-04 18:00:11

 国际学术期刊发文证实: 预防服用连花清瘟可降低新冠阳性率和发热率
国际学术期刊发文证实: 预防服用连花清瘟可降低新冠阳性率和发热率2022-03-08

 科兴集团国企还是私企?董事长是陶晓明吗
科兴集团国企还是私企?董事长是陶晓明吗2022-04-26
- 什么是阴痛?
2021-10-26 10:33:42
- 美立方国内外专家齐聚 颌面专家团再升级
2021-08-23 11:47:40
- 《热点聚焦》医疗机构内新冠病毒感染防控有了新要求
2021-09-15 20:00:10
- 浙大一院2021年中秋节、国庆节放假及工作安排
2021-09-12 14:00:03
- 什么是阴结?
2021-10-26 10:33:42