JITC:新研究将弓形虫变成杀死癌症的武器
- 2022-07-26 18:00:10 健康一线
- 健康
为了防止免疫细胞对不适当的触发因素作出反应或将这种反应拖得太长,它们配备了称为免疫检查点的分子保障措施,附近的免疫细胞可以开启这些分子保障措施。尽管这些免疫检查点很重要,但许多肿瘤劫持它们来抑制抗肿瘤免疫反应。一种常见的免疫疗法---称为免疫检查点阻断,也称为免疫检查点抑制,旨在通过物理阻断免疫检查点分子,使它们无法传递抑制性信号,从而对抗它们的这种免疫抑制作用。尽管这种治疗在一些患者身上是成功的,但在许多其他患者身上却失败了,科学家们并不完全知道其中的原因,或者更重要的是,如何克服肿瘤的免疫抑制。揭开这一谜团的关键线索来自一个意想不到的来源:居住在大脑中的寄生虫---刚地弓形虫(Toxoplasma gondii)。
用大脑寄生虫对付癌症的想法产生于20世纪60年代和70年代,当时科学家们观察到弓形虫感染提高了小鼠对几种感染(Science, 1968, doi:10.1126/science.160.3823.72)和包括癌症(The Journal of Infectious Diseases, 1971, doi:10.1093/infdis/124.6.587)在内的疾病的免疫力。在此后的几十年里,关于弓形虫感染可以帮助癌症治疗的证据越来越多。
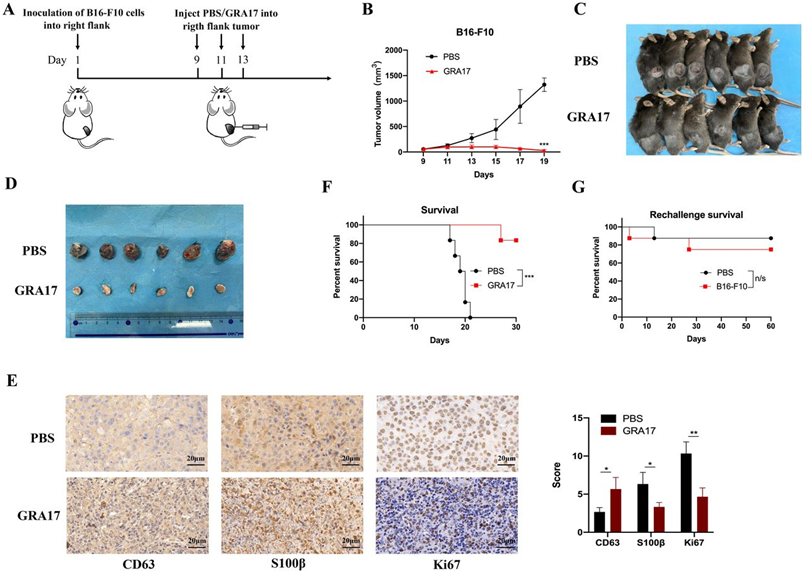
在一项新的研究中,来自中国宁波大学和美国斯坦福大学医学院等研究机构的研究人员发现相比于仅用免疫检查点抑制剂治疗,在用免疫检查点抑制剂治疗小鼠的同时,将弓形虫直接注射到它们的肿瘤中,可让接受过弓形虫注射的肿瘤和身体其他部位的肿瘤都缩小了。相关研究结果近期发表在Journal for ImmunoTherapy of Cancer期刊上,论文标题为“Synergy between Toxoplasma gondii type I ΔGRA17 immunotherapy and PD-L1 checkpoint inhibition triggers the regression of targeted and distal tumors”。
达特茅斯学院盖泽尔医学院免疫寄生虫学家David Bzik说,“这些发现真地很耐人寻味,[而且]在未来可能很重要,因为人们对免疫检查点阻断疗法有很大的兴趣,并进行了大肆宣传和商业化。”他补充说,这些结果可能有助于使免疫检查点抑制剂疗法对最初没有反应的患者更加有效。
但是该领域的专家们指出挑战仍然存在,特别是在实际实施基于活体寄生虫的治疗方面。尽管如此,他们说,即使这样的治疗没有成功,弓形虫最终可能会帮助癌症患者。
宾夕法尼亚大学免疫寄生虫学家Christopher Hunter(未参与这项新的研究)说,“我认为你可以用这个系统来建立可能导致更好疗法的原则。如果你能理解这种寄生虫发挥的其他免疫疗法没有发挥的作用,那么也许你可以利用这种知识来开发新的抗癌疗法。”
一种治疗癌症的大脑寄生虫
弓形虫是一种单细胞的真核寄生虫,只能在宿主细胞内复制。它经常在土壤或水中发现,或者在受感染动物的肉中发现。在加州州立大学东湾分校研究弓形虫的微生物学家Pascale Guiton(未参与这项新的研究)说,“弓形虫是一种相当普遍的寄生虫,与一些只在特定生物体内感染某些细胞类型的病原体不同。它可以感染几乎所有的温血动物,并且可以感染几乎所有的有核细胞。进入宿主细胞后,这种寄生虫形成保护性空泡,这种保护性空泡容纳复制性的寄生虫,直到宿主细胞爆裂后它们释放出来---在这个过程中杀死宿主细胞--并感染新的细胞并在其中进行复制。”Guiton指出,一旦感染了动物,这种寄生虫通常会在宿主的余生中潜伏在骨骼肌和脑细胞中。
根据Guiton的说法,世界上三分之一的人类被认为感染了这种寄生虫。对于大多数人来说,弓形虫是相当无害和无体育bd的;然而,对于免疫力低下的人、孕妇和发育中的胎儿来说,这种感染可能是致命的,因为目前还没有疫苗或治疗慢性弓形虫病的方法。
使用一种有潜在危险的寄生虫来抗击癌症可能看起来像把患者从油锅里扔到火里,但使用病原体来治疗癌症的想法可以追溯到一个多世纪以前。
大约在二十世纪初,纽约癌症外科医生William Coley在阅读旧的患者记录时有了一个惊人的发现:七年前,一名晚期癌症患者感染了细菌。这似乎不值得一提,除了这名本应在几年前就死于癌症的患者仍然活着并且表现良好。Coley猜测这种细菌感染导致了肿瘤的缩小,因此他开始进行实验,给自己的癌症患者注射活的或死的细菌。如果患者在感染后存活下来(不是所有的人都存活下来),他们经常会注意到他们的肿瘤缩小,他们的预后发生改善。最后,Coley将他的治疗方法标准化,变成了一种由死细菌组成的疫苗,称为科利毒素(Coley’s toxin)。给患者注射这种疫苗可以诱发杀死癌症的炎症,而不必冒着感染活病原体的风险。
然而,随着时间的推移,科利毒素作为一种癌症治疗方法不再受到医生的青睐。达特茅斯学院盖泽尔医学院肿瘤免疫学家Steven Fiering说,“很多人试图复制Coley的研究工作,但他们没有得到很好的效果。”他补充说,辐射作为一种癌症治疗方法的出现迅速取代了科利毒素的流行。但提高免疫系统以抗击癌症的一般想法仍然存在。
将免疫刺激疗法直接递送到肿瘤中被称为原位疫苗接种(in situ vaccination)。根据Fiering的说法,这种疫苗接种作为一种辅助手段来启动抗肿瘤免疫反应,这种反应往往被肿瘤细胞部署的一些自我保护策略所削弱。Fiering说,这个想法是为了消除肿瘤部位的局部免疫抑制,并产生肿瘤特异性T细胞,这些T细胞可以识别并杀死身体其他部位的转移瘤,甚至在临床医生发现它们之前。
除了科利毒素之外,科学家们还探索了原位疫苗接种策略,比如给肿瘤注射减毒的单核细胞增生李斯特菌(导致食源性疾病李斯特菌病的细菌)(Oncoimmunology, 2014, doi:10.4161/onci.28926),或者包被或填充有病原体衍生抗原的纳米颗粒(Science Advances, 2021, doi:10.1126/sciadv.abf1244)。比如,在2016年,Fiering团队证实填充着被杀死的植物病原体---豇豆花叶病毒---的纳米颗粒可以抑制多种小鼠癌症(包括卵巢癌、结肠癌和乳腺癌)模型中的转移性肿瘤生长(Nature Nanotechnology, 2016, doi:10.1038/nnano.2015.292)。一种名为T-Vec的疗法,基于注射到肿瘤中的溶瘤病毒,正被用于治疗晚期黑色素瘤。
除了这种原位疫苗接种之外,关注弓形虫的一个原因是它所引起的免疫反应类型。Hunter解释说,“病原体有不同的种类。我们需要不同类型的免疫反应来对抗不同类型的感染。”
Hunter说,与为对抗细菌或寄生虫而优化的免疫反应类型不同,免疫系统用于对抗细胞内感染(如弓形虫)的机制与你想要激活对抗癌症的途径相同,包括强大的T细胞反应和细胞因子,如IL-12和干扰素γ。
Bzik说,“当[弓形虫]被引入肿瘤时,它真地驱动了你想要看到的确切免疫反应,以消除它们。你重新唤醒了这种免疫反应,你逆转了免疫抑制。”
此外,尽管弓形虫采用了巧妙的免疫逃避策略,但这种寄生虫也因触发免疫系统而广为人所知,这是一种反直觉的自我保护尝试。这是因为这种寄生虫需要它的宿主存活足够长的时间,以便在它的生命周期中达到准备传递下去的阶段。在弓形虫感染之初,这种寄生虫以一种快速复制的形式---称为速殖子(tachyzoite)---存在。速殖子侵入宿主细胞,进行复制,然后宿主细胞爆裂,造成宿主细胞死亡以及大规模的全身和局部炎症。几周后,在最初的炎症爆发中存活下来的寄生虫会躲藏在长寿的细胞类型中,如骨骼肌和大脑中的细胞。在这些细胞类型中,这种寄生虫过渡到一种缓慢复制的形式---称为缓殖子(bradyzoite),并构建糖墙(a wall of sugars)来保护它们免受宿主免疫防御。有时,充满寄生虫的包囊(cyst)会破裂,引起局部炎症,但是在其他情况下,这种寄生虫可以在宿主的余生中以包囊形式生存。然后,如果含有包囊的组织被新的宿主摄入,弓形虫可以传播给新的宿主。
如果宿主在这种寄生虫处于速殖子形态时死亡,这种寄生虫将不会被传播,因为这种形态会在消化道内死亡。只有当弓形虫被安全地容纳在包囊内时,这种寄生虫才足够稳定,可以在它的宿主被吃掉时传播。为了确保它的后代和宿主都能存活足够长的时间,弓形虫实际上在感染的早期阶段通过触发强大的免疫反应(虽然还没强到把速殖子都消灭掉)来控制它自身的复制。
使弓形虫对原位疫苗接种具有吸引力的另一点是它在入侵不同细胞和组织类型方面的多功能性。这种寄生虫对入侵肿瘤组织并不挑剔,可以在多种模式生物中进行测试。
2010年,为了对弓形虫进行基因修饰以用作预防弓形虫病的疫苗,Bzik和他的实验室报告了敲除一个合成嘧啶的关键酶,以构建一种不能复制的弓形虫虫株(Infection and Immunity, 2010, doi:10.1128/IAI.00287-10)。这种虫株可以在补充了尿嘧啶的培养基中正常生长,但不能在哺乳动物宿主中复制,因为那里的这种RNA碱基不能自由地被清除掉。然后,在2013年,Bzik、Fiering和他们的同事发现,在一种卵巢癌的小鼠模型中,感染这种虫株能明显提高肿瘤浸润性T细胞的数量和活性(Cancer Research, 2013, doi:10.1158/0008-5472.CAN-12-1974)。事实上,仅仅注射来自遭受这种虫株感染的荷瘤小鼠的T细胞,就足以显著抑制其他受癌症困扰但未被这种虫株感染的小鼠的肿瘤生长。其他研究显示,这种寄生虫对胰腺癌(Oncoimmunology, 2016, doi:10.1080/2162402X.2015.1104447)和黑色素瘤(Journal of Immunology, 2013, doi:10.4049/jimmunol.1201209)的小鼠模型也很有效。
诺丁汉大学兽医Hany Elsheikha和他在中国的同事在这篇新论文中把这些发现向前推进了一步,他们发现感染一种复制减弱的弓形虫虫株(与Bzik实验室开发的弓形虫虫株不同)使多种类型的肿瘤对免疫检查点抑制敏感,导致CD8+T细胞和自然杀伤细胞涌入,杀死癌细胞并缩小肿瘤,比单独使用检查点抑制剂效果更好。这种组合疗法只有在小鼠接受活体寄生虫治疗时才有效---注射热杀死的寄生虫对肿瘤的缩小没有影响。他们还发现,当他们给小鼠植入两个肿瘤,用免疫检查点抑制剂进行全身治疗,但只给其中的一个肿瘤注射这种寄生虫时,另一个肿瘤仍然缩小。
Bzik说,他发现这些结果很耐人寻味,尤其是在治疗晚期癌症方面。他指出,癌症治疗的不幸现实是,许多患者直到他们的癌症已经转移才被诊断出来,因此几乎不可能治疗或切除所有肿瘤。但是,有了这个新的观察结果,即这种组合疗法也会攻击小鼠的远端肿瘤,也许有可能用一种也会攻击转移性肿瘤的疗法来靶向攻击原发性肿瘤。
尽管取得了一些有希望的结果,Fiering说,他几年前最终放弃了用弓形虫作为原位癌症疫苗的做法,因为存在着一个巨大的技术障碍。由于弓形虫只能在宿主细胞内生长和繁殖,培养它需要在烧瓶或培养皿中的单层细胞,这样这种寄生虫才可以感染并在里面繁殖。可以将这种寄生虫从宿主细胞中提取出来并冷冻起来长期储存,然后在一个装有新鲜细胞的烧瓶中解冻和复活,但这需要几天时间才能使这种寄生虫数量反弹到有用的滴度。
根据Fiering的说法,这在临床上是不可行的。他回忆说,他与达特茅斯学院的临床医生讨论了使用弓形虫作为免疫疗法的潜力。他记得他们说,“我们需要的是可以从冰箱、冰柜或货架上拿出来注射到病人身上的东西,而不是每隔几天就要从活细胞培养物中提取的东西。”他说,要使它发挥作用并非不可能,但从临床角度来看,这也是不现实的。
弓形虫ΔGRA17虫株能显著降低小鼠体内黑色素瘤的生长。图片来自Journal for ImmunoTherapy of Cancer, 2022, doi:10.1136/jitc-2021-002970。
撇开技术挑战不谈,所有与《科学家(The Scientist)》杂志交谈的科学家们都怀疑,涉及向患者注射活体寄生虫的疗法---尤其是对免疫力低下的患者特别危险的寄生虫---能否在临床上立足,即使是减毒的寄生虫版本。
弓形虫作为一种工具
然而,基于弓形虫的治疗从来不是Elsheikha及其同事们的计划。Elsheikha说,“我们没有把它作为一种治疗方法来推广。”他说,相反,他们研究的目标是弄清楚到底是什么原因使弓形虫感染在克服肿瘤对免疫检查点抑制的抵抗性和缩小肿瘤方面如此有用。
Elsheikha认为弓形虫不是简单的病原体,而是理解基本生物机制的有力工具。他想知道弓形虫迫使靶细胞改变它们的正常生物学的能力是否能以一种创新的方式加以利用和开发。他说,“这正是我们在研究中所做的。”
弓形虫的另一个巨大优势是它的遗传可操作性。Hunter说,“与其他许多模式生物不同,科学家们对弓形虫进行基因改造的历史由来已久。与其他很多寄生虫相比,它的基因操纵相对容易。”他说,这使得免疫学家很容易将这种寄生虫作为一种工具来回答有关免疫系统的问题,例如通过敲除某些基因来确定哪些途径对抗肿瘤免疫反应很重要。例如,他指出他的团队所做的研究工作已表明细胞因子L-27如何在弓形虫感染期间抑制免疫反应,这导致了在晚期实体瘤中阻断IL-27的1期临床试验。
根据Guiton的说法,这项新研究的结果可以告诉我们需要什么类型的免疫反应来对抗这些肿瘤,然后基于此,这些作者可以开始反向开展研究工作,以便回答一个大问题:“我们如何在没有完整的寄生虫的情况下重现这种反应?”
一个线索来自于Elsheikha团队的观察,即死亡的寄生虫并没有引起同样的反应,这表明可能是这种寄生虫分泌的蛋白而不是它表面的蛋白引起了免疫反应。
Bzik说,此外,从癌症生物学的角度来看,了解这种寄生虫感染如何促进免疫检查点阻断疗法是关键。他说,“有一些获得美国食品药品管理局(FDA)批准的免疫检查点抑制剂药物。但是,临床医生不知道为什么某些癌症的一部分患者甚至很多患者在治疗后没有反应。”他补充说,如果人们能够弄清楚这种寄生虫感染是如何克服肿瘤的免疫抑制的,他们可能会找到改善免疫检查点阻断疗法的方法。
Guiton说,利用寄生虫获得治疗效果并非闻所未闻,“但我们不能更多地利用它们的原因是我们对它们的生物学没有足够的了解”。她说,这种新见解的缺乏部分上源于缺乏对基础寄生虫学研究的资助,尤其是在那些没有受到寄生虫严重影响的国家。
她说,“为了我们能够为其他目的(比如治疗癌症)探究这些寄生虫,我们真地需要研究它们,了解发生了什么。” (生物谷 Bioon.com)
参考资料:
Yu-Chao Zhu et al. Synergy between Toxoplasma gondii type I ΔGRA17 immunotherapy and PD-L1 checkpoint inhibition triggers the regression of targeted and distal tumors. Journal for ImmunoTherapy of Cancer, 2022, doi:10.1136/jitc-2021-002970.
本文地址://www.styjt.com/jiankang/2022-07-26/600793.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- 创新型药物研发领先企业益方生物成功登陆科创板2022-07-26 18:00:11
- 台湾新增24790例新冠肺炎本地确诊病例2022-07-26 18:00:11
- 兰州针对特殊人群清单化服务 “一对一”回应居民诉求2022-07-26 18:00:11
- 北京市2022年全民数字素养与技能提升月启动2022-07-26 18:00:11
- 重庆市调整退休人员基本养老金2022-07-26 18:00:11

 国际学术期刊发文证实: 预防服用连花清瘟可降低新冠阳性率和发热率
国际学术期刊发文证实: 预防服用连花清瘟可降低新冠阳性率和发热率2022-03-08

 科兴集团国企还是私企?董事长是陶晓明吗
科兴集团国企还是私企?董事长是陶晓明吗2022-04-26
- 什么是阴痛?
2021-10-26 10:33:42
- 12345连续三次不处理怎么办,1天打3次12345有什么后果?
2022-05-20 09:55:29
- 美立方国内外专家齐聚 颌面专家团再升级
2021-08-23 11:47:40
- 《热点聚焦》医疗机构内新冠病毒感染防控有了新要求
2021-09-15 20:00:10
- 小剂量,大能量!久哥他达非拉片5mg-OAD规律/灵活抗ED!
2022-07-20 16:41:21