特应性皮炎(AD)新药!IL-13抑制剂lebrikizumab在欧盟进入审查:持久清除皮损,缓解瘙痒!
- 2022-10-31 18:00:13 健康一线
- 健康
2022年10月31日讯 /生物谷BIOON/ --Almirall是一家专注于皮肤健康的全球生物制药公司。近日,该公司宣布,欧洲药品管理局(EMA)已受理新型抗炎药IL-13抑制剂lebrikizumab治疗中度至重度特应性皮炎(atopic dermatitis,AD)的营销授权申请(MAA)。Almirall预计,lebrikizumab预计将在2023年上半年在欧洲获得批准,该药有潜力为患者提供一款同类最佳(best-in-class)治疗选择。AD是一种慢性炎症性皮肤病,影响欧盟高达4.4%的成年人,在过去几十年里,患病率似乎有所上升。
lebrikizumab MAA基于3项关键3期临床研究。ADvocate 1研究和ADvocate2研究评估了lebrikizumab作为单药疗法用于治疗中度至重度AD成人患者和青少年患者(12岁至18岁以下,体重至少40kg);ADhere研究评估了lebikizumb与局部皮质类固醇(TCS)联合治疗。结果显示,在2项单药试验(ADvocate 1和2)的16周诱导期接受lebrikizumab(每2周一次)治疗且在第16周取得临床应答的患者,在维持期继续接受lebrikizumab治疗至一年,实现了持久的皮损清除和瘙痒缓解。结果还显示,在16周诱导期接受lebrikizumab(每2周一次)治疗之后,维持期lebrikizumab每4周一次方案与每2周一次方案具有相似的疗效。
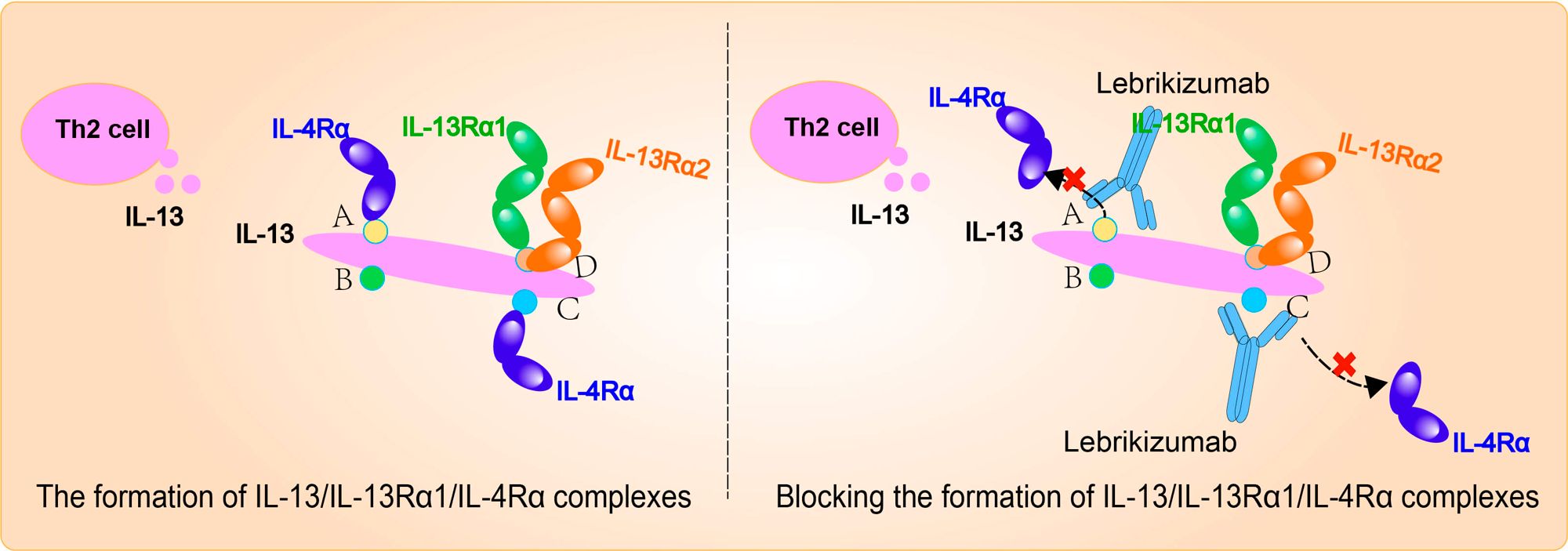
lebrikizumab是一种新型单克隆抗体(mAb),能够以高亲和力结合可溶性IL-13,具有高生物利用度、长半衰期,可阻断IL-13信号转导。
Almirall已获授权在欧洲开发和商业化lebrikizumab,用于治疗包括AD在内的皮肤病适应症。礼来拥有lebrikizumab在美国、欧洲以外其他国家的独家开发和商业化权利。此前,美国FDA已授予lebrikizumab治疗中重度AD成人和青少年患者(12岁至18岁以下,体重≥40公斤)的快速通道资格(FTD)。
特应性皮炎(AD)也称为特应性湿疹,是一种由皮肤屏障功能障碍和免疫反应失调引起的慢性炎症性皮肤病。AD患者经常报告有强烈、持续的瘙痒体育bd,这种瘙痒非常令人不舒服,会影响睡眠、日常活动和社交关系。在AD患者中,IL-13蛋白(疾病的中心致病介质)过度表达,通过促进辅助性T细胞2(Th2)细胞炎症,从而驱动AD病理生理学的多个方面,导致皮肤屏障功能障碍、瘙痒、感染、皮肤区域变硬增厚。
lebrikizumab作用机制(点击图片查看大图,来源:mosmedpreparaty.ru)
今年6月,礼来公布了lebrikizumab治疗中度至重度特应性皮炎(AD)2项关键3期临床研究(ADvocate 1,ADvocate 2)疗效和安全性一年分析的顶线结果。这2项研究评估了lebrikizumab作为单一疗法治疗中重度AD成人和青少年患者(12岁至18岁以下,体重至少40kg)的疗效和安全性,主要疗效终点在第16周时进行评估:研究者总体评估(IGA)为皮损完全清除(IGA评分为0)或几乎完全清除(IGA评分为1)且相对基线改善≥2分、湿疹面积和严重程度指数(EASI)评分相对基线改善≥75%。
之前公布的16周结果显示:2项研究均达到了主要终点和全部次要终点,包括皮损清除、瘙痒改善、生活质量改善。采用EASI评估,有一半以上的患者湿疹面积和严重程度指数(EASI)评分相对基线改善≥75%(EASI-75)。
此次公布的新数据显示,在2项研究中:治疗16周取得临床应答(EASI-75)的患者,接受lebrikizumab每2周或每4周一次方案治疗一年后,约有80%的患者仍然维持皮损清除。此外,在一年期间,患者继续保持瘙痒缓解。
具体而言:在ADvocate 1研究中,接受lebrikizumab每4周一次治疗的患者中有79%、接受每2周一次治疗的患者中有75%在治疗一年后维持EASI-75。在ADvocate 2研究中,接受lebrikizumab每4周一次治疗的患者中有85%、接受每2周一次治疗的患者中有79%在治疗一年后维持EASI-75。在接受lebrikizumab治疗的患者中,不良事件频率和总体安全性状况与试验的诱导期以及之前的lebrikizumab AD研究一致。在该患者群体中未观察到新的安全信号。(生物谷Bioon.com)
原文出处:Almirall announces EMA acceptance for filing of Marketing Authorization Application (MAA) for lebrikizumab in atopic dermatitis
本文地址://www.styjt.com/jiankang/2022-10-31/610888.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- 哈尔滨市七区实施临时管控措施2022-10-31 18:00:16
- 两部门:推进社区适老化、适儿化改造2022-10-31 18:00:16
- 突遇踩踏事故应如何避险自救?2022-10-31 18:00:16
- 聚力打造国际化现代康养服务者品牌,北京城投健康开启品牌升级新篇章2022-10-31 18:00:16
- 七部门:明星不得为未使用过的商品作推荐、证明2022-10-31 18:00:16

 科兴集团国企还是私企?董事长是陶晓明吗
科兴集团国企还是私企?董事长是陶晓明吗2022-04-26

 国际学术期刊发文证实: 预防服用连花清瘟可降低新冠阳性率和发热率
国际学术期刊发文证实: 预防服用连花清瘟可降低新冠阳性率和发热率2022-03-08
- 12345连续三次不处理怎么办,1天打3次12345有什么后果?
2022-05-20 09:55:29
- 2022南宁封控小区名单表 南宁最新封闭小区名单2022年8月什么情况
2022-08-26 09:52:30
- 什么是阴痛?
2021-10-26 10:33:42
- 航天员6个月工资有多少 王亚平老公赵鹏退役了吗
2022-04-18 09:41:37
- 小剂量,大能量!久哥他达非拉片5mg-OAD规律/灵活抗ED!
2022-07-20 16:41:21
文章排行榜
- 周排名
- 月排名
- 1庆祝羊膜间充质干细胞抗衰老研讨会暨盛康生物科技有限公司成立
- 2瑞思迈全新产品发布 推动睡眠呼吸领域个性化新体验
- 3次密接隔离多少天可以解除 次密接隔离7天后还需要居家隔离吗
- 42022年10月25日11时入山东济南最新通告今天 山东济南出入通知今天最新规定
- 52022年10月26日09时湖南长沙疫情最新出入政策 湖南长沙疫情防控最新政策规定
- 6关于“青春疼痛”,我们漏聊了最重要的一点
- 72022年10月25日10时今天今明出入吉林长春疫情最新政策规定通知 离吉林长春人员最新规定 到达吉林长春最新防疫要求
- 8稳得希林:医用再生材料加持,开启创面快速修复愈合时代
- 9稳得希林:拓宽再生医学材料应用面,建立创面快速愈合新标准
- 10截止10月25日08时新疆和田地区疫情实时动态 新疆和田地区疫情最新确诊数感染人数