APL Bioengin:揭示转移性癌症促进血管渗漏的分子机制
- 2022-12-13 18:00:23 健康一线
- 健康
预防癌症转移(癌细胞在其原始位点之外的发展)仍然是当前研究研究的主要目标之一,大多数恶性肿瘤细胞能通过利用血管的异常渗漏来进行转移,近日,一篇发表在国际杂志APL Bioengineering上题为“Interacting with tumor cells weakens the intrinsic clockwise chirality of endothelial cells”的研究报告中,来自密歇根大学迪尔伯恩分校等机构的科学家们通过研究揭示了血管内皮细胞的排列在癌症扩散中的分子机制以及其所扮演的关键角色。
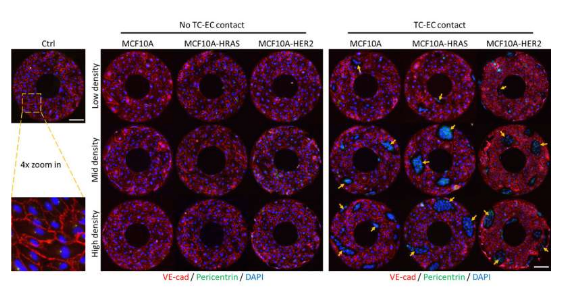
这项研究中,研究人员开发了一种新型模型,其或能帮助分析内皮细胞和肿瘤细胞之间的局部沟通以及其对内皮细胞排列的影响,这种方法主要涉及使用共培养的人类脐静脉内皮细胞(HUVECs,human umbilical vein endothelial cells)和人类乳腺上皮肿瘤细胞系来刺激肿瘤-内皮细胞之间的相互作用。研究者Jie Fan说道,肿瘤组织中的血管要比正常组织中的血管更易发生渗漏,我们非常好奇是否肿瘤细胞能诱导内皮细胞的顺时针方向的弱化效应,并诱发其在血管中功能的混乱。
本文研究扩展了最近的研究结果,结果发现,内皮细胞或具有一定的手性特性(chirality),且其更倾向于想顺时针方向倾斜;手性是一种类似于左右手的镜像定向特征;研究者认为,内皮细胞的强大顺时针方向手性特征对于维持血管的完整性非常重要,但很不幸的是,其会被肿瘤细胞损伤或减弱,从而增加癌细胞转移的风险;而保留这种正常的手性特征或许能通过增强血管中内皮细胞屏障的完整性和手性来抑制肿瘤的转移。
揭示转移性癌症促进血管渗漏的分子机制。
图片来源:APL Bioengineering (2022). DOI:10.1063/5.0115827
为了解决这个问题,研究人员利用不同恶性程度的一系列肿瘤细胞系与HUVECs进行共培养,随后他们比较了当肿瘤细胞直接接触HUVECs或与其不接触时,HUVECs是如何产生反应的,为了施加这种程度的控制,研究者采用了一种接触性的印刷技术来创建甜甜圈或八字形的微图案来容纳细胞。研究者发现,HUVECs的顺时针手性会受到局部激素信号的影响,而与肿瘤细胞的直接物理接触则影响会更大一些;肿瘤细胞上的特定蛋白会与内皮细胞上的蛋白质结合,这似乎在改变HUVECs的顺时针手性特征上扮演着重要角色。
研究人员对这些细胞类型的移动感到非常惊讶,在大多数转移性模型中,在肿瘤细胞破碎进入血液之前会奔向血管;研究者Fan说道,我们推测肿瘤细胞会入侵机体的内皮细胞,然而我们发现内皮细胞正朝着微型图像上的肿瘤细胞移动。这种相互作用或许能帮助更好地控制癌症的转移,他们希望能进一步研究开发新型疗法;综上,本文研究结果揭示了内皮细胞-肿瘤细胞之间的物理相互作用在内皮细胞的手性特性上扮演着重要角色,而减弱内皮细胞的手性或许能潜在损伤内皮组织的总体完整性,从而增加转移性癌症扩散的可能性。(生物谷Bioon.com)
原始出处:
Benson Hang, Eman Jassem, Hanan Mohammed, et al. Interacting with tumor cells weakens the intrinsic clockwise chirality of endothelial cells, APL Bioengineering (2022). DOI:10.1063/5.0115827

本文地址://www.styjt.com/jiankang/2022-12-13/617897.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- 八部门:启动实施重点群体创业推进行动2022-12-13 18:00:25
- 防疫政策调整后多地现“囤药热”,免疫之王NADH新一轮热潮开启2022-12-13 18:00:25
- 倡导“治未病”健康新模式,扬子江药业集团积极承担社会责任2022-12-13 18:00:25
- 北京:完善新冠肺炎患者分级诊疗服务网络2022-12-13 18:00:25
- 国家卫健委回应BQ.1.1变异株有关情况2022-12-13 18:00:25

 烟台今天已封闭的小区 烟台现在封闭小区名单有哪些
烟台今天已封闭的小区 烟台现在封闭小区名单有哪些2022-10-12

 张家界桑植新娘吴梅婚纱照事件完整版 看女主出轨聊天内容视频
张家界桑植新娘吴梅婚纱照事件完整版 看女主出轨聊天内容视频2022-11-11
- 目前南岸区及江北封闭小区名单有哪些 看最新封控通告
2022-11-11 14:49:26
- 科兴集团国企还是私企?董事长是陶晓明吗
2022-04-26 17:23:14
- 国际学术期刊发文证实: 预防服用连花清瘟可降低新冠阳性率和发热率
2022-03-08 09:09:50
- 2022南宁封控小区名单表 南宁最新封闭小区名单2022年8月什么情况
2022-08-26 09:52:30
- 70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗
2022-11-07 17:44:38
文章排行榜
- 周排名
- 月排名
- 1千金藤素片“老药新用”临床研究取得阶段性成果
- 2共话医疗国械新智造,平安银行与生态伙伴们相聚这场沙龙!
- 3启达力®荆防颗粒获《山东省新冠病毒肺炎中医药防治方案》力荐!
- 4关于阳性的前兆和表现 阳了一般几天转阴 阳性吃什么好的快 新冠的潜伏期一般几天具体来龙去脉
- 5一图读懂:新冠肺炎三药三方全知道
- 6阿根廷克罗地亚历史战绩 阿根廷克罗地亚历史比分 克罗地亚与阿根廷交战记录
- 7儿童新冠常备药物清单 | 宁宝®获《山东新冠防治方案》力荐!
- 8今日速报:阳性的前兆和表现 阳了一般几天转阴 阳性吃什么好的快 新冠的潜伏期一般几天
- 9今日最新消息:喝酒能消灭奥密克戎吗 盐水对奥密克戎有效吗 专家预估疫情高峰期
- 10三叶草生物新冠疫苗被纳入紧急使用