《自然》:分析近10万个人体脑细胞,中国科学家终破解最常见儿童脑瘤起源之谜!
- 2022-12-19 18:00:19 健康一线
- 健康
髓母细胞瘤(MB)是最常见的儿童恶性脑肿瘤。
MB可分为4个亚群:WNT活化型、SHH活化型、Group3型和Group4型[1]。不同的MB亚群起源于发育中的小脑或脑干的不同细胞谱系,对治疗的反应差异也较大[2]。
其中,Group3型MB(G3-MB,约占MB的20%,原癌基因Myc活化)是最具侵袭性及预后最差的亚类[3],然而,其起源目前尚无定论。
以往科学家们对MB肿瘤起源的探索主要基于小鼠模型[2, 4],但人类小脑的表面积要比小鼠大750倍,有更多的原始祖细胞群体[5, 6],因而了解人类小脑发育过程中的细胞演变,对于寻找G3-MB的起源至关重要。
近日,由辛辛那提儿童医院医学中心的Richard Lu领导的中美研究团队,在《自然》杂志发表重磅研究[7],通过对人类胎儿大脑进行了单细胞分析,构建了小脑早期发育过程中的细胞图谱,并发现了一种独特的过渡性小脑祖细胞(以高表达HNRNPH1和SOX11为特征),而且它的转录特征与G3-MB高度相似。
他们还通过3D基因组结构分析证实,HNRNPH1/SOX11可促进过渡性小脑祖细胞发展为G3-MB肿瘤细胞。好消息是,他们证实靶向HNRNPH1/SOX11可抑制G3-MB肿瘤的生长。
这些研究的结果提示此前发现的过渡性小脑祖细胞很可能就是G3-MB的起源细胞,而且该类肿瘤的标志物HNRNPH1/SOX11可作为潜在的治疗靶点,G3-MB有望迎来新疗法。辛辛那提儿童医院医学中心的Luo Zaili和Zhao Chuntao,复旦大学附属儿科医院的Xia Mingyang和Shi Wei,以及上海交通大学医学院附属新华医院的Wang Jiajia是论文的共同第一作者。
论文首页截图
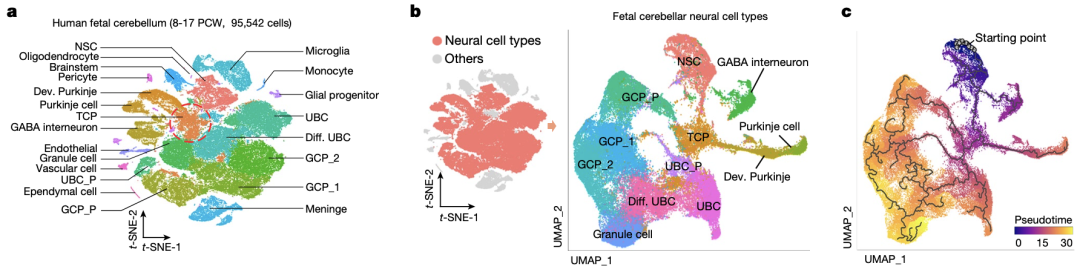
为了构建人类小脑发育过程中的细胞图谱,研究人员从孕后第8-17周的流产胎儿中分离出新鲜的小脑组织,并进行了单细胞RNA测序(scRNA-seq)。无监督聚类分析将所获得的95542个细胞分成了23个亚群,然后结合不同细胞系的典型标志物对其进行注释,识别出了人类胎儿小脑的主要细胞类型。
紧接着,研究人员通过干性评分描绘了神经细胞的群体演变轨迹,发现从神经干细胞到3个小脑的主要神经细胞系——颗粒细胞祖细胞(GCP)、单极刷状细胞(UBC)和Purkinje细胞之间存在过渡性小脑祖细胞(TCP)
从神经干细胞到3个小脑的主要神经细胞系之间存在TCP
TCP在孕12周和13周时大量存在,在孕14周后期数目逐渐减少。TCP群体以高表达HNRNPH1和SOX11为特征,与先前定义的神经干细胞、GCP和UBC细胞群体特征不同,而与菱形唇(RL)中细胞基因特征存在一定相似性,这也与先前奇点报道的关于G3-MB起源的研究结果相一致[8, 9]。此外,TCP群体的分子特征在任何已知的小鼠小脑细胞群体中都没有富集。
TCP的分子特征不同于神经干细胞、GCP和UBC等细胞群体
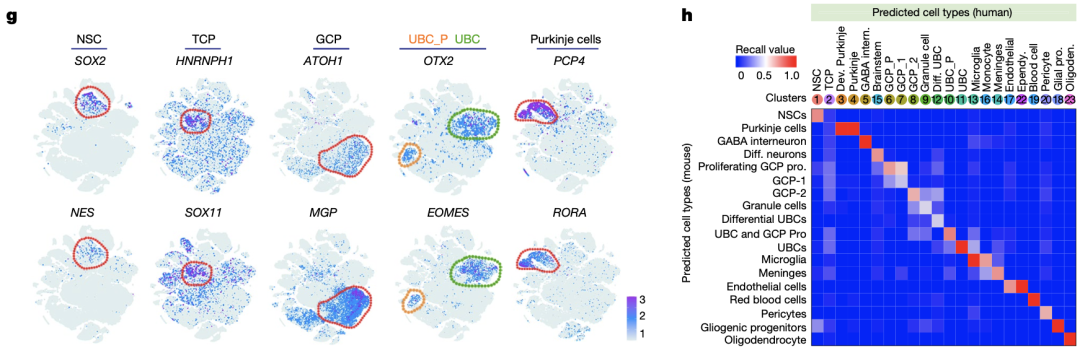
那新发现的细胞群体与MB存不存在关系呢?研究人员将儿童MB队列的转录组数据与TCP的转录特征进行比对,发现G3-MB与人类胎儿TCP群体相似性最强。
为了进一步确定TCP与小脑MB的联系,研究人员对26个MB组织进行了scRNA-seq和单核染色质转座酶可及性测序分析(snATAC-seq,研究染色质中DNA能与转录因子等蛋白复合物结合的区域)。
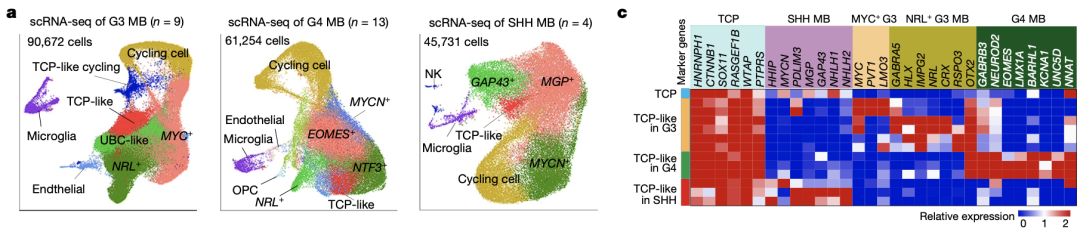
研究结果表明,在G3-MB、G4-MB和SHH活化型MB中均可发现类似TCP的细胞群体(同样高表达HNRNPH1和SOX11),而TCP样细胞群体在G3-MB中的丰度高于G4-MB和SHH活化型MB。这些结果表明,TCP细胞很有可能会演变为特定的肿瘤性TCP样细胞,也就是G3-MB的起源细胞。
TCP细胞很有可能是G3-MB的起源细胞
此外,研究人员还发现,在一个原发肿瘤同时含有G3-MB和G4-MB组织类型的肿瘤病人中,其转移到脑膜处的肿瘤组织中TCP样细胞和MYC+G3-MB细胞的频率都有所增加,但G4-MB细胞有所减少,表明TCP样细胞与G3-MB细胞具有一致的高侵袭性。
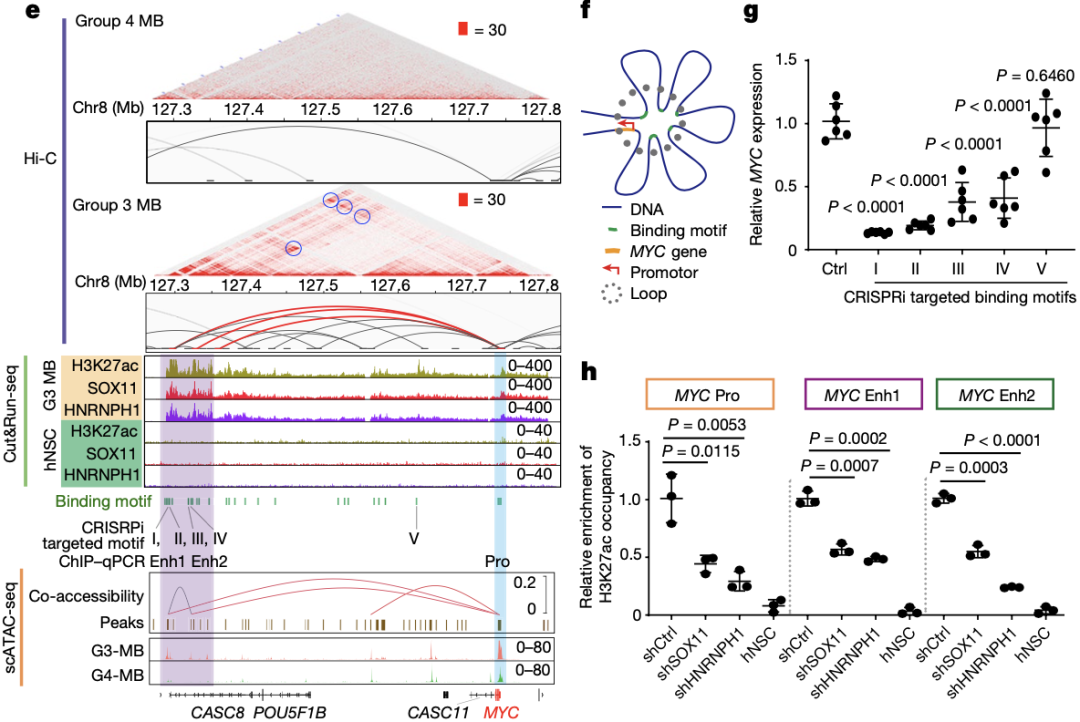
为了探究顺式调控元件(CRE)的动态可及性与侵袭性MB的TCP样细胞基因调控的关系,研究人员对G3-MB进行了snATAC-seq,并进行伪时间序列分析,发现TCP样细胞群出现优先于MYC+细胞群,在TCP样细胞中,SOX11和TWIST1的结合域明显富集,而在MYC+细胞群中则是TCF3和MYC结合域明显富集。
同时,G3-MB肿瘤细胞的GO分析,在TCP样细胞群体中,上皮发育、上皮-间质转化(EMT)和TGFb/BMP信号显著富集,这与其具有的高侵袭性相一致。
以上结果均再次表明了TCP样细胞就是G3-MB细胞的“老祖宗”。那么TCP样细胞是如何转变为G3-MB肿瘤细胞的呢?
研究人员基于患者来源的MYC活化的G3-MB肿瘤细胞系(MB-004和MB-002),发现TCP样细胞中高表达的SOX11/HNRNPH1可驱动原癌基因Myc活化,导致G3-MB的发生。
TCP样细胞中高表达的SOX11/ HNRNPH1可驱动原癌基因MYC活化
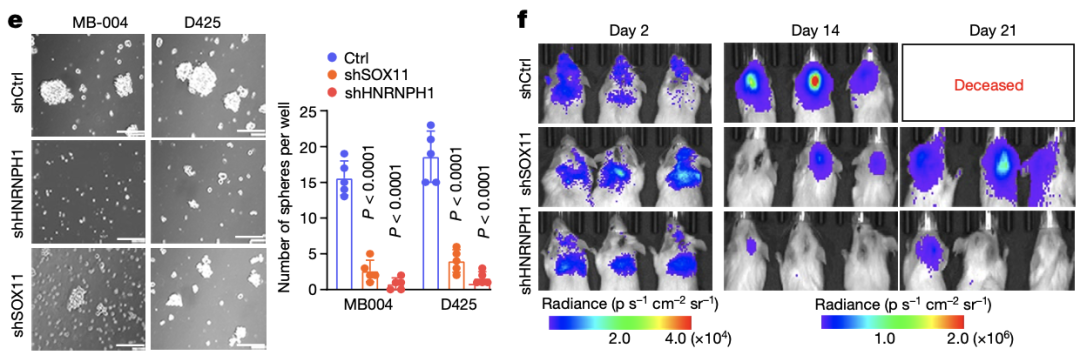
最后,研究人员发现,通过短发夹RNA(shRNA)沉默肿瘤细胞中的HNRNPH1或SOX11后,观察到Myc表达的大幅降低,并抑制了肿瘤细胞的生长。
此外,体内实验也表明,在HNRNPH1或SOX11被沉默后,G3-MB肿瘤生长速度也被明显抑制,小鼠的生存期明显延长,表明TCP标志性基因HNRNPH1和SOX11的表达,对侵袭性G3-MB肿瘤的生长至关重要。
体内及体外实验表明TCP标志性基因HNRNPH1和SOX11的表达对G3-MB肿瘤的生长至关重要
总的来说,本研究通过建立人胎儿小脑细胞发育图谱,找到了一类新的介于神经干细胞和成熟神经元之间的过度细胞,该细胞群体以表达HNRNPH1和SOX11为特征,且证实了HNRNPH1和SOX11可驱动原癌基因Myc的活化,从而导致G3-MB肿瘤的发生发展。
更重要的是,HNRNPH1和SOX11还可作为干预靶点来抑制肿瘤的生长,若能找到可特异性干预这两个靶点的小分子化合物,或将成为G3-MB治疗的新方向。
参考文献
1.Wang J, Garancher A, Ramaswamy V, Wechsler-Reya RJ: Medulloblastoma: From Molecular Subgroups to Molecular Targeted Therapies. Annu Rev Neurosci 2018, 41:207-232.
2.Vladoiu MC, El-Hamamy I, Donovan LK, Farooq H, Holgado BL, Sundaravadanam Y, Ramaswamy V, Hendrikse LD, Kumar S, Mack SC et al: Childhood cerebellar tumours mirror conserved fetal transcriptional programs. Nature 2019, 572(7767):67-73.
3.Pugh TJ, Weeraratne SD, Archer TC, Pomeranz Krummel DA, Auclair D, Bochicchio J, Carneiro MO, Carter SL, Cibulskis K, Erlich RL et al: Medulloblastoma exome sequencing uncovers subtype-specific somatic mutations. Nature 2012, 488(7409):106-110.
4.Hovestadt V, Smith KS, Bihannic L, Filbin MG, Shaw ML, Baumgartner A, DeWitt JC, Groves A, Mayr L, Weisman HR et al: Resolving medulloblastoma cellular architecture by single-cell genomics. Nature 2019, 572(7767):74-79.
5.Aldinger KA, Thomson Z, Phelps IG, Haldipur P, Deng M, Timms AE, Hirano M, Santpere G, Roco C, Rosenberg AB et al: Spatial and cell type transcriptional landscape of human cerebellar development. Nat Neurosci 2021, 24(8):1163-1175.
6.Haldipur P, Aldinger KA, Bernardo S, Deng M, Timms AE, Overman LM, Winter C, Lisgo SN, Razavi F, Silvestri E et al: Spatiotemporal expansion of primary progenitor zones in the developing human cerebellum. Science 2019, 366(6464):454-460.
7.Luo Z, Xia M, Shi W, Zhao C, Wang J, Xin D, Dong X, Xiong Y, Zhang F, Berry K et al: Human fetal cerebellar cell atlas informs medulloblastoma origin and oncogenesis. Nature 2022.
8.Smith KS, Bihannic L, Gudenas BL, Haldipur P, Tao R, Gao Q, Li Y, Aldinger KA, Iskusnykh IY, Chizhikov VV et al: Unified rhombic lip origins of group 3 and group 4 medulloblastoma. Nature 2022, 609(7929):1012-1020.
9.Hendrikse LD, Haldipur P, Saulnier O, Millman J, Sjoboen AH, Erickson AW, Ong W, Gordon V, Coudiere-Morrison L, Mercier AL et al: Failure of human rhombic lip differentiation underlies medulloblastoma formation. Nature 2022, 609(7929):1021-1028.

本文地址://www.styjt.com/jiankang/2022-12-19/619228.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- 全球精子数量下降,人工智能助力男性测试精子质量2022-12-19 18:00:22
- 强直性脊柱炎健康乡村项目帮扶8000多名患者,助力乡村振兴新征程2022-12-19 18:00:22
- 12月19日零时起沈阳市各医疗机构门急诊取消查验就诊患者48小时核酸阴性证明2022-12-19 18:00:22
- 南京即日起每天向市场投放200万片退烧药 每人限购6粒2022-12-19 18:00:21
- 上海:全市各类社区卫生服务机构2594间发热诊间全部启用2022-12-19 18:00:21

 烟台今天已封闭的小区 烟台现在封闭小区名单有哪些
烟台今天已封闭的小区 烟台现在封闭小区名单有哪些2022-10-12

 张家界桑植新娘吴梅婚纱照事件完整版 看女主出轨聊天内容视频
张家界桑植新娘吴梅婚纱照事件完整版 看女主出轨聊天内容视频2022-11-11
- 目前南岸区及江北封闭小区名单有哪些 看最新封控通告
2022-11-11 14:49:26
- 70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗
2022-11-07 17:44:38
- 科兴集团国企还是私企?董事长是陶晓明吗
2022-04-26 17:23:14
- 国际学术期刊发文证实: 预防服用连花清瘟可降低新冠阳性率和发热率
2022-03-08 09:09:50
- 2022南宁封控小区名单表 南宁最新封闭小区名单2022年8月什么情况
2022-08-26 09:52:30
文章排行榜
- 周排名
- 月排名
- 1今日速报:感染新冠不能吃什么 阳性居家工资发放标准 阳性员工工资如何支付 快递放置2天病毒能死吗
- 2抗原t深c浅说明什么 为什么测出来T比C还要颜色深
- 3最新成人流感规范急诊专家共识发布,流感遇上新冠,你准备好了吗
- 4kn95能防新型冠状病毒吗,kn95医用和非医用有什么区别
- 5睿视科技完成5000万人民币A轮融资,蓝驰创投领投,国药中金联合投资!
- 6发烧睡不着要硬睡吗,发烧睡不着可以吃安眠药吗
- 7关于新冠放屁是在排毒吗 吸烟人新冠到1到7天反应 大蒜杀冠状病毒吗 新冠拉肚子是什么阶段具体来龙去脉
- 8抗原结果怎么上传到健康码,抗原结果上传到健康码会显示24小时吗
- 924小时前沿半岛电子下载入口 :全国各城市感染高峰进度怎么查
- 10生命科学产业的快速崛起--费城