“突破性”阿尔茨海默病新药获批:延缓27%大脑衰退,但2.65万美元/年定价存争议
- 2023-01-14 08:00:18 健康一线
- 健康
美国食品和药品管理局(FDA)通过加速审批途径批准了Leqembi(lecanemab-irmb)用于治疗阿尔茨海默病(AD)。Leqembi是全球首款临床证明服药1年半减缓27%记忆力和思维衰退的AD药物,帮助处于AD早期阶段的人们保持心智。Eisai和Biogen合作研发了Leqembi,并将其定价为2.65万美元/年。定价监管机构(ICER)表示,该药物定价在8500美元至2.06万美元之间“具有成本效益”,高于此价格将“难以达到成本效益阈值”。
Leqembi:非治愈性药物,可在AD早期去除大脑淀粉样蛋白斑块
虽然AD具体病因尚不完全清楚,但大致为脑蛋白质无法正常运作,从而扰乱脑细胞(神经元)的功能,引发一系列毒性事件,导致神经元受损,彼此连接丢失,并最终死亡。这类损伤通常始于负责控制记忆的大脑区域,但此过程在初始体育bd出现前几年就开始了;随后,神经元丢失会以某种可预测的模式扩散到大脑的其他区域;最后,到了疾病晚期,大脑已经明显萎缩。因此,在AD早期,阻止脑蛋白质的异常,减少淀粉样蛋白斑块对AD的治疗极为重要。 Leqembi是一种人源化免疫球蛋白G1(IgG1)抗淀粉样蛋白β(Aβ)单克隆抗体,能够选择性结合以中和及清除可溶性毒性β淀粉样蛋白聚集体。尽管之前许多针对淀粉样蛋白的药物未能减缓患者智力丧失的速度,但临床研究表明每隔一周静脉注射一次Leqembi,可以去除大脑中的淀粉样蛋白。FDA根据Leqembi基于PET成像测量的淀粉样斑块负担减少随机对照临床试验(Study 201)的结果,决定在加速审批途径下批准该药物用于治疗AD。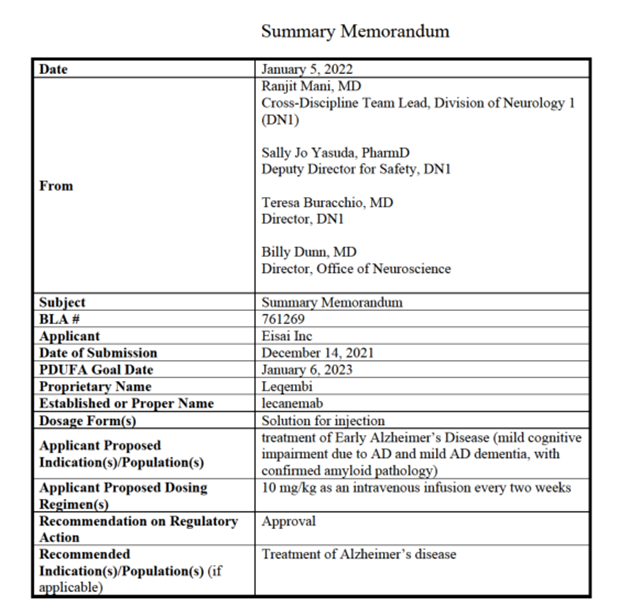 图1 FDA药物评估和研究中心发布的Leqembi总结回顾(图源:[1])
图1 FDA药物评估和研究中心发布的Leqembi总结回顾(图源:[1])
01Leqembi达到临床所有关键次要终点
Study 201是一项多中心、随机、双盲、安慰剂对照、平行组设计研究,研究对象是856名由于AD或轻度AD痴呆症导致的轻度认知损害(MCI)患者。通过PET测量脑淀粉样斑块的变化,并在第53周和第79周通过复合标准摄取值比(SUVR)评估患者亚组的脑淀粉样斑块变化,并作为支持加速批准的终点。 结果发现Leqembi以剂量和时间依赖的方式减少脑淀粉样斑块,达到了所有关键的次要终点。与安慰剂组相比,每两周使用10mg/kg的Leqembi组从基线到第79周的脑淀粉样斑块有统计学意义上的减少。第53周AD综合评分的初步分析表明,Leqembi 10mg/kg双周给药方案(64%)优于安慰剂组(25%)。第79周的数据表明,临床终点的下降减少了约20%至40%。
02Leqembi存在副作用
Leqembi最常见的副作用是淀粉样蛋白相关影像学异常(ARIA)、头痛和输注相关反应。ARIA最常见的表现为大脑区域的暂时性肿胀和积液(ARIA-E),并且可能伴有大脑内部或表面的小出血点及浅表铁质沉着症(ARIA-H),有些人可能会出现头痛、意识模糊、头晕、视力下降、恶心和癫痫发作等体育bd。输注相关反应包括流感样体育bd、恶心、呕吐和血压变化。 在每两周使用10mg/kg Leqembi治疗组中,ARIA-E发生率为10%,输注反应为20%,而安慰剂治疗组ARIA-E为1%,输注反应为3%。使用Leqembi 10 mg/kg治疗的参与者最常见的体育bd是头痛、混乱/精神状态改变、激动和视觉障碍。Leqembi输注反应88%发生在第一次输注时,轻度发生率为56%,中度为44%,体育bd包括发烧和流感样体育bd(发冷、全身疼痛、感觉发抖和关节痛)。Study 201中无死亡案例。
Leqembi 3期临床:延缓27%记忆思维衰退,但有3人死亡
1月5日,NEJM发布了Leqembi全球3期临床试验(Clarity AD)结果[2]。Clarity AD是一项为期18个月的全球多中心、安慰剂对照、双盲、平行、开放期延续的3期临床试验,旨在评估Leqembi治疗早期AD的有效性及安全性。日本、美国、欧洲、中国、韩国、加拿大、澳大利亚和新加坡的235个研究中心纳入了1,795例早期AD患者。值得期待的是,中国也参与了该药的3期临床试验,共收集111例患者,由于中国研究入组开始较晚,临床试验仍在进行中,中国患者结果预计2023年下半年揭晓,以揭示不同人种是否有疗效差异[3]。
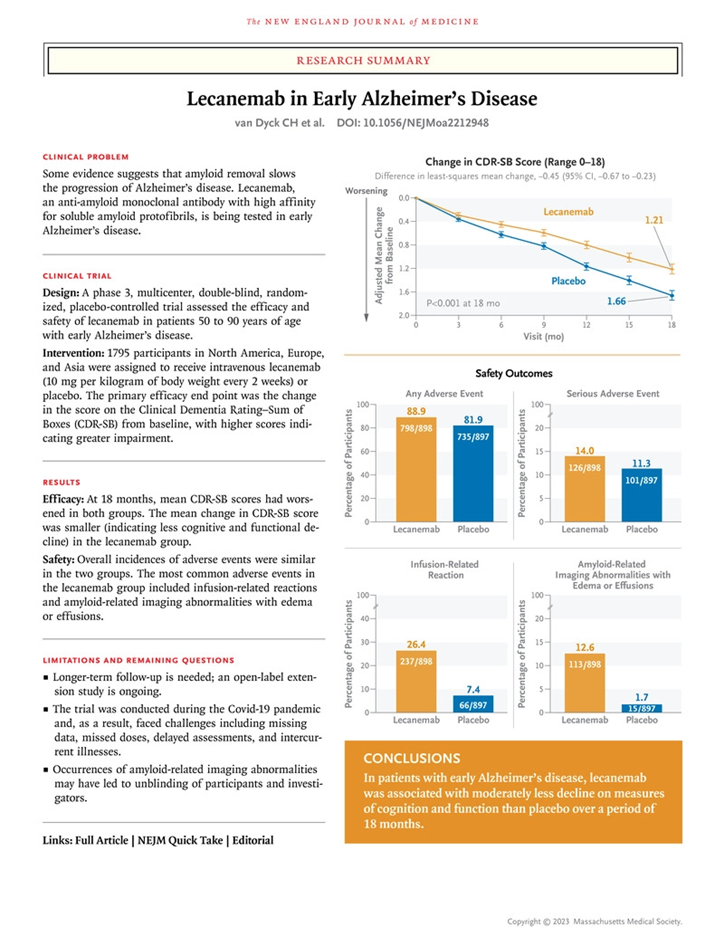 图2 Leqembi全球3期临床试验结果(图源:[2]) 在Clarity AD临床试验中,早期AD患者在18个月时间里每两周接受一次静脉注射Leqembi或安慰剂,研究人员采用痴呆认知评定量表如CDR-SB、ADAS-cog、ADCOMS和ADCS-MCI-ADL等,在用药组获得了比对照组有显著意义的评分,提示Leqembi明显改善了认知功能,并提示用药的患者进展到疾病下一阶段的可能性要明显降低(31%),27%患者在一年半的时间内推迟了记忆力和思维衰退体育bd。但是ARIA-E的发生率在Leqembi组为12.6%,在安慰剂组为1.7%。对于ARIA-H或出血迹象,发生率分别为17.3%和9.0%。 在3期临床中有3例死亡:第一例为一名正在服用血液稀释剂阿哌沙班(Eliquis)的心房颤动患者;第二例为因急性中风接受了组织型纤溶酶原激活剂(tPA)的65岁参与者,t-PA和Leqembi的组合可能引发了致命的脑出血和出血级联反应;第三例为一名79岁的参与者,出现大面积脑肿胀、出血以及癫痫发作。
图2 Leqembi全球3期临床试验结果(图源:[2]) 在Clarity AD临床试验中,早期AD患者在18个月时间里每两周接受一次静脉注射Leqembi或安慰剂,研究人员采用痴呆认知评定量表如CDR-SB、ADAS-cog、ADCOMS和ADCS-MCI-ADL等,在用药组获得了比对照组有显著意义的评分,提示Leqembi明显改善了认知功能,并提示用药的患者进展到疾病下一阶段的可能性要明显降低(31%),27%患者在一年半的时间内推迟了记忆力和思维衰退体育bd。但是ARIA-E的发生率在Leqembi组为12.6%,在安慰剂组为1.7%。对于ARIA-H或出血迹象,发生率分别为17.3%和9.0%。 在3期临床中有3例死亡:第一例为一名正在服用血液稀释剂阿哌沙班(Eliquis)的心房颤动患者;第二例为因急性中风接受了组织型纤溶酶原激活剂(tPA)的65岁参与者,t-PA和Leqembi的组合可能引发了致命的脑出血和出血级联反应;第三例为一名79岁的参与者,出现大面积脑肿胀、出血以及癫痫发作。
西北大学神经病理学家Rudolph Castellani在11月发表在Science上的一篇文章中更明确地指出了Leqembi在患者死亡中的作用。Castellani表示:“在我看来,这是一种由Leqembi治疗引起的疾病和死亡,对此我毫不怀疑。”
进行临床试验的Marwan Sabbagh和Christopher van Dyck认为没有足够的证据将死亡归咎于Leqembi。他们在NEJM的随附回复信中表示:“单独使用t-PA治疗也会导致致命性出血。早前有报道称,在没有任何抗淀粉样蛋白药物的情况下,t-PA治疗患有脑淀粉样血管病的人会发生致命的灾难性脑内出血。”
针对死亡事件,医生们表示:“对于使用某些血液稀释剂和带有APOE4基因的患者,我们会谨慎使用Leqembi,因为这些患者具有较高的副作用风险。但是,我们会给AD患者开Leqembi而不是Aduhelm,因为有更多证据表明Leqembi是有效的。”
Leqembi定价为2.65万美元/年,ICER认为价格过高
Eisai和Biogen最终将Leqembi定价为2.65万美元/年。Eisai表示此前根据Ⅱ期结果计算出的“年度价格”范围为9,200美元至3.56万美元,在将Ⅲ期数据作为“药物社会价值”的一部分考虑后,该价格上涨至3.7万美元。但是,考虑到此前推出的同类药物Aduhelm因成本和疗效问题而导致销售惨淡,且联邦医疗保险(CMS)限制了抗淀粉样蛋白药物的承保范围,65岁以上患者必须参加临床试验才能获得医疗保险服务,Leqembi的定价最终下调为2.65万美元/年。医药分析师认为Aduhelm和Leqembi的定价相似,投资者预期接近Biogen和Eisai为Aduhelm的2.8万美元/年定价。大多数新药都在定价方面受到审查,但Leqembi受到了特别关注,因为没有其他药物可以改变AD的进程。Aduhelm最初的定价为5.6万美元/年,但由于Aduhelm的临床意义争论、患者死亡报告引发的安全担忧加剧,以及可能会出现的大量患者,其年度价格最终被削减至2.82万美元。虽然价格进行了调整,但与Biogen曾经预期的数十亿美元销售额相比,Aduhelm销售额依然很糟糕。 定价监管机构ICER表示,鉴于AD患者数量众多,Leqembi的定价与其对患者的价值相符尤为重要。Leqembi定价在8,500美元至2.06万美元之间“具有成本效益”,高于此的定价“不会达到典型的成本效益阈值”。 Us Against Alzheimer表示:“现在应该可以买到Leqembi,但如果没有医疗保险,只有支付得起每年2.65万美元的富人才能获得这种治疗,这使得数百万AD患者无法获得这种治疗。Leqembi的定价应该秉承公平原则,适当定价,让每个AD患者都从中受益。” Leqembi的发明者、Eisai合作伙伴Lars Lannfelt在接受采访时称Aduhelm的定价是一个“错误”,但他不愿对Leqembi的价格发表评论,只是表示每个AD患者都应该受益于Leqembi。

本文地址://www.styjt.com/jiankang/2023-01-14/623191.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- 国家能源局:入冬以来能源供应经受住多轮寒潮天气的考验2023-01-14 08:00:20
- 日本决定今年春夏期间开始排放福岛第一核电站核污染水2023-01-14 08:00:20
- 国家发改委:全国能源供需总体平稳有序2023-01-14 08:00:19
- 内蒙古政协委员赵海平:扩重症队伍 保老龄健康 建医疗救援队2023-01-14 08:00:19
- 东北大学最新研究成果:超高强钢铁材料领域实现新突破2023-01-14 08:00:19

 70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗
70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗2022-11-07

 烟台今天已封闭的小区 烟台现在封闭小区名单有哪些
烟台今天已封闭的小区 烟台现在封闭小区名单有哪些2022-10-12
- 张家界桑植新娘吴梅婚纱照事件完整版 看女主出轨聊天内容视频
2022-11-11 14:27:00
- 目前南岸区及江北封闭小区名单有哪些 看最新封控通告
2022-11-11 14:49:26
- 无人售货机功能(无人自动售货机操作方法介绍)
2022-07-27 08:41:09
- 科兴集团国企还是私企?董事长是陶晓明吗
2022-04-26 17:23:14
- 国际学术期刊发文证实: 预防服用连花清瘟可降低新冠阳性率和发热率
2022-03-08 09:09:50
文章排行榜
- 周排名
- 月排名




