Molecular Cancer: 肿瘤外泌体在卵巢癌转移中的最新机制
- 2023-02-24 18:00:18 健康一线
- 健康
卵巢癌(OvCa)是女性最致命的妇科恶性肿瘤之一。与其他实体肿瘤一样,在卵巢癌患者中,癌症转移占癌症相关死亡的绝大多数。跨卵巢或腹膜转移是卵巢上皮细胞向腹膜腔内扩散的最主要途径。
转移定植是肿瘤转移的关键步骤之一。转移前的生态位是转移定植所必需的,并由肿瘤-间质相互作用决定,但其机制基础仍不完全清楚。
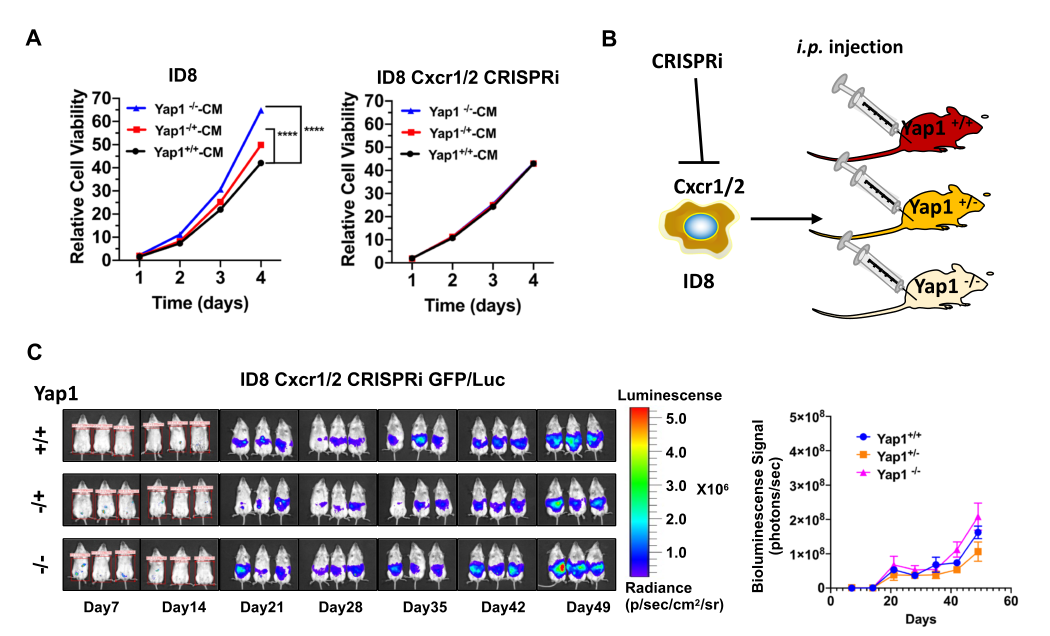
图片来源:https://doi.org/10.1186/s12943-022-01703-9
近日,来自香港大学的研究者们在Molecular Cancer杂志上发表了题为“Tumor-secreted exosomal miR-141 activates tumor-stroma interactions and controls premetastatic niche formation in ovarian cancer metastasis”的文章,该研究发现miR-141作为卵巢癌来源的外体微RNA,通过激活YAP1/Groα/CXCRs信号通路,介导肿瘤-间质相互作用和促肿瘤间质生态位的形成,为卵巢癌腹膜转移患者的治疗提供了新的视角。
在本研究中,研究者基于聚合酶链式反应的miRNome图谱、定量聚合酶链式反应、免疫荧光分析评估外体miR-141的表达和细胞间通讯。LC-MS/MS蛋白质组学分析和双荧光素酶分析证实YAP1是miR-141的直接靶标。
人类细胞因子谱、芯片、荧光素酶报告分析和亚细胞分级分析证实YAP1调节GROα的产生。一系列体外致瘤实验、体外模型和YAP1CKO小鼠模型证实了miR141/YAP1/Groα/CXCR1/2信号转导通路的作用。RNAi、CRISPR/Cas9和CRISPRi系统用于基因沉默。包括血清、卵巢癌组织标本和组织阵列用于临床相关性研究。
HSA-miR-141-3p(miR-141)是一种外体miRNA,由卵巢癌细胞高度分泌,将间质成纤维细胞重新编程为促炎性肿瘤相关成纤维细胞(CAF),促进转移定植。一项机制研究表明,miR-141靶向于河马途径的关键效应因子YAP1,降低核YAP1/TAZ比率,并促进基质成纤维细胞Groα的产生。
在小鼠模型中,YAP1的基质特异性敲除形成了Groα丰富的微环境,促进了体内肿瘤的定植,但这种作用在Ovca细胞中的CXCR1/2缺失后被逆转。在临床样本中证实了YAP1/GROα的相关性,突出了这项研究的临床相关性,并为阻止卵巢癌转移前生态位的形成和转移进展提供了潜在的治疗干预措施。
CXCR1/2缺失损害OvCa细胞的致癌潜能
图片来源:https://doi.org/10.1186/s12943-022-01703-9
研究者阐明了OvCa来源的外体microRNA miR141的升高与OvCa的进展有关,并且miR-141的内部机制重塑了基质细胞的促肿瘤表型。基于这项研究,研究者认为YAP1是YAP1/TAZ/TEAD1转录复合体的抑制子,在基质细胞中直接受到外体miR-141的调节,从而促进Groα的产生,Gro DNA在卵巢癌转移前的利基中含量丰富。
GRO-α是促进卵巢癌细胞增殖、迁移/侵袭和肿瘤体外定植的致癌趋化因子之一。应用CRISPRi技术同时沉默卵巢细胞表面Groα受体CXCR1/CXCR2,减少了Groα介导的促癌效应,为卵巢癌患者的治疗提供了新的视角。未来治疗卵巢癌的新疗法可能集中在针对Groα受体的单抗或基于真核细胞的CRISPR基因编辑技术。(生物谷 Bioon.com)
参考文献
Yulan Mo et al. Tumor-secreted exosomal miR-141 activates tumor-stroma interactions and controls premetastatic niche formation in ovarian cancer metastasis. Mol Cancer. 2023 Jan 9;22(1):4. doi: 10.1186/s12943-022-01703-9.

本文地址://www.styjt.com/jiankang/2023-02-24/628869.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- 内蒙古煤矿坍塌事故调整救援方案 避免发生次生灾害影响2023-02-24 18:00:20
- 中央气象台:弱冷空气将影响华北东北2023-02-24 18:00:20
- 文化和旅游部:深化高校共建助推文化和旅游高质量发展2023-02-24 18:00:20
- 本轮疫情是否已经结束?官方最新研判2023-02-24 18:00:20
- 港深联合发布十六条措施促进跨境知识产权合作2023-02-24 18:00:20

 70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗
70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗2022-11-07

 梅婷现任70岁老公曾剑个人资料(曾剑个人资料)
梅婷现任70岁老公曾剑个人资料(曾剑个人资料)2022-09-08
- 烟台今天已封闭的小区 烟台现在封闭小区名单有哪些
2022-10-12 09:07:30
- 张家界桑植新娘吴梅婚纱照事件完整版 看女主出轨聊天内容视频
2022-11-11 14:27:00
- 目前南岸区及江北封闭小区名单有哪些 看最新封控通告
2022-11-11 14:49:26
- 无人售货机功能(无人自动售货机操作方法介绍)
2022-07-27 08:41:09
- 2022南宁封控小区名单表 南宁最新封闭小区名单2022年8月什么情况
2022-08-26 09:52:30