《自然》:颠覆认知!哈佛科学家发现,先天免疫重要因子TBK1竟是癌症免疫逃逸的帮凶
- 2023-02-24 18:00:18 健康一线
- 健康
癌细胞表面有能被免疫细胞识别的肿瘤抗原,而癌症免疫疗法正是一种通过激活免疫系统来治疗癌症的方法。
但是在某些情况下,癌细胞会通过营造其特殊的肿瘤微环境,来逃避免疫监视和攻击,例如通过调节某些免疫检查点通路,因此,免疫检查点抑制剂成为了一种有效的癌症免疫疗法药物。
但是,检查点抑制剂疗法只对一小部分癌症患者有效,某些患者的癌细胞并不受免疫检查点抑制剂药物影响(先天抗性),或者在治疗过程中发展出了抗性(获得性抗性),因此,目前亟需开发有效的治疗手段来克服癌症免疫疗法抗性。
近日,由哈佛医学院麻省总医院的Russell W. Jenkins和Robert T. Manguso领衔的研究团队,在国际顶尖杂志《自然》发表关于克服癌症免疫疗法抗性的最新研究成果[1]。
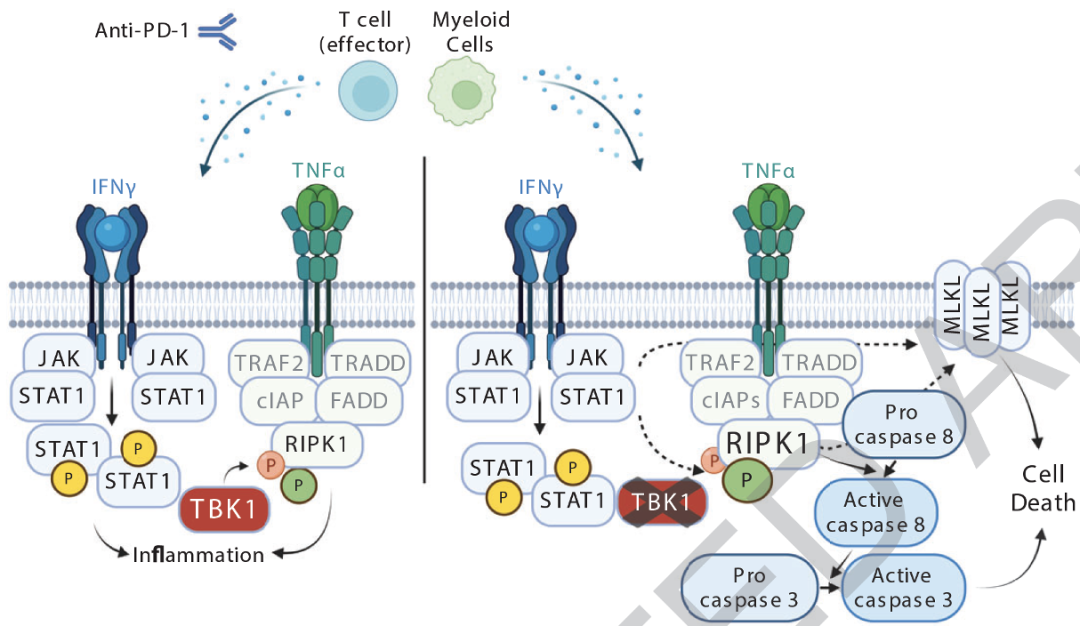
他们发现对于先天免疫反应十分重要的蛋白激酶TBK1,竟是癌细胞的免疫逃逸因子,敲除Tbk1的黑色素瘤细胞对效应细胞因子TNFα和IFNγ的敏感性增加,导致它对免疫检查点抑制剂的响应显著增强。
他们还发现,TBK1抑制剂TBK1i与免疫检查点抑制剂联用可以显著增强对于人类患者来源的肿瘤模型的治疗效果。
总的来说,这项研究揭示了一个新的癌细胞免疫逃逸因子TBK1,靶向TBK1有潜力发展成为克服癌症免疫疗法抗性的有效治疗措施。
文章首页截图
TBK1是一个具有多种功能的丝氨酸/苏氨酸蛋白激酶,参与先天免疫反应。
早在2017年,Manguso等发表在《自然》上的研究表明,敲除Tbk1可以显著增强免疫检查点抑制剂疗法对于黑色素瘤的效果[2]。
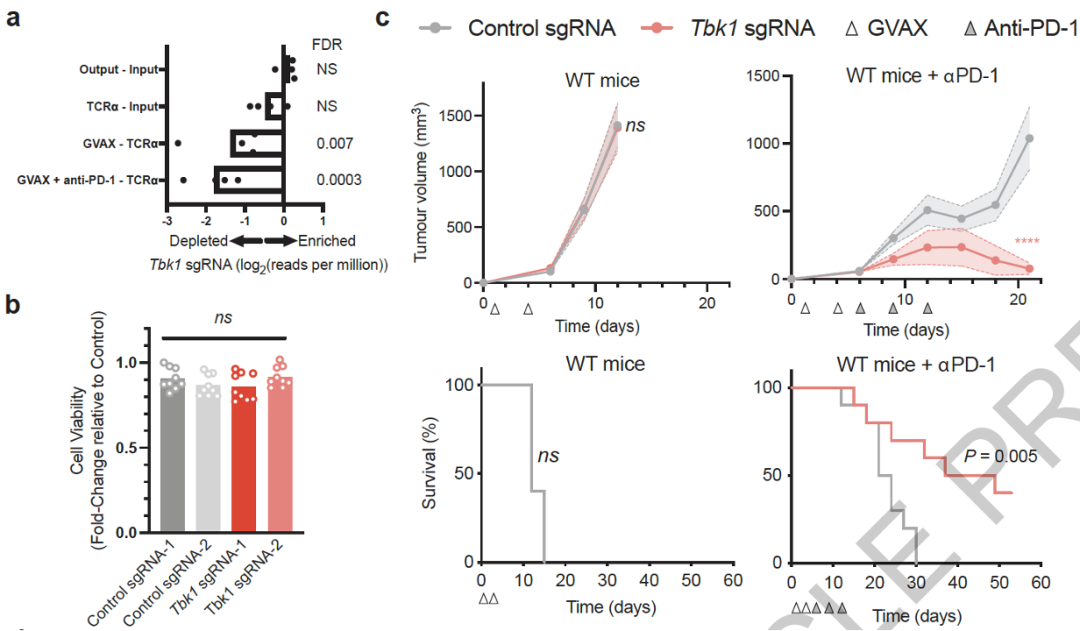
为了进一步挖掘TBK1参与癌症免疫的机制,Jenkins和Manguso领衔的团队这一次利用CRISPR-Cas9构建了敲除Tbk1的小鼠黑色素瘤细胞系。
这些细胞与正常黑色素瘤细胞在培养基以及在免疫缺陷小鼠体内的生长速率没有显著差别,甚至在免疫功能完好的野生型小鼠体内的生长速率也与正常黑色素瘤没有显著差别,但是当用免疫检查点抑制剂(PD-1抑制剂)处理时,缺失Tbk1的黑色素瘤细胞生长被显著抑制,患肿瘤小鼠的存活率也得到提升。
因此,Tbk1缺失会增强黑色素瘤对于癌症免疫疗法的敏感性。
敲除Tbk1增强肿瘤对于PD-1抑制剂的敏感性
接下来,他们用小分子TBK1抑制剂TBK1i处理,发现当TBK1i与免疫检查点抑制剂联用时可以显著降低小鼠体内的肿瘤生长速率,并且不会表现出毒性效应。
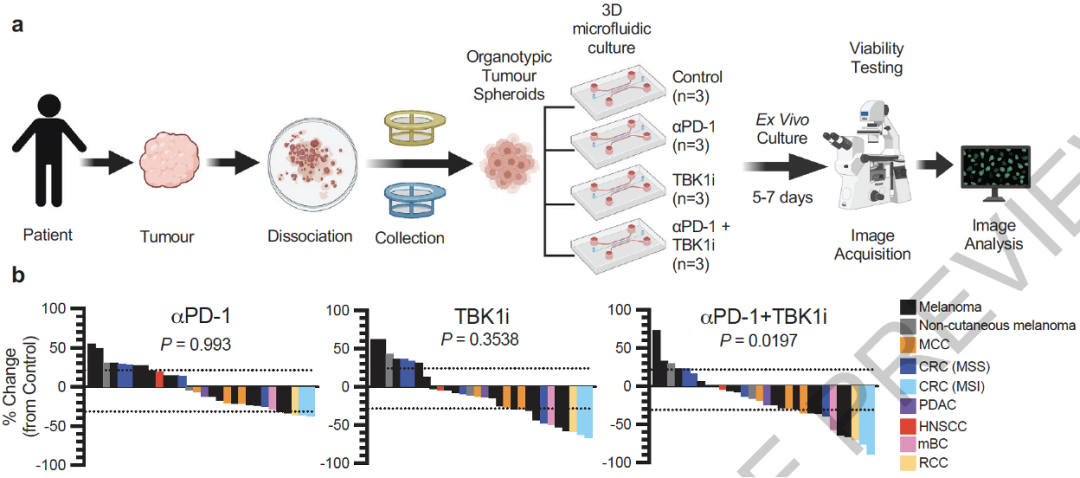
在体外,他们利用来源于小鼠的器官型肿瘤球状体(MDOTS)进一步验证了TBK1i与免疫检查点抑制剂联用的效果,甚至是来源于对免疫检查点抑制剂耐药的MDOTS,TBK1i与免疫检查点抑制剂联用也具有显著效果。
为了进一步检测TBK1i在人类肿瘤中的效果,他们分析了30个患者来源的器官型肿瘤球状体(PDOTS),其中有15个皮肤黑色素瘤、2个非皮肤黑色素瘤和13个其他癌症类型。对于单独的免疫检查点抑制剂处理只有16.6%的PDOTS有响应,对于单独的TBK1i处理有30%的PDOTS有响应,而对于TBK1i与免疫检查点抑制剂联用有40%的PDOTS有响应。
并且,即使是来源于对免疫疗法耐药的转移性皮肤黑色素瘤患者的PDOTS,TBK1i与免疫检查点抑制剂联用也具有效果。除了黑色素瘤之外,对于其他癌症类型,如结直肠癌,TBK1i与免疫检查点抑制剂联用也具有效果。
抑制TBK1增强PDOTS对于PD-1抑制剂的敏感性
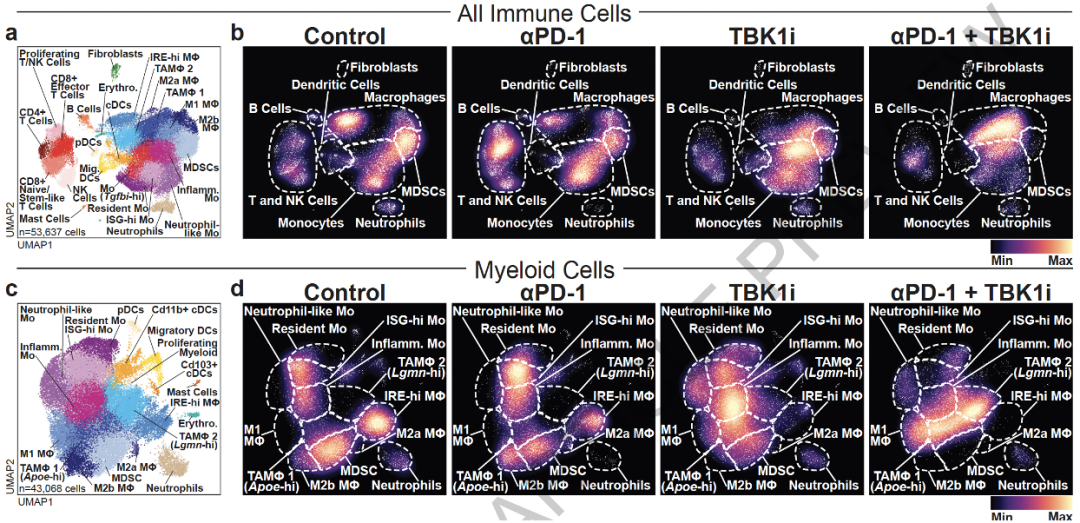
那么TBK1的作用机制是什么呢?他们猜测TBK1抑制剂可能会影响肿瘤的免疫微环境。
通过单细胞转录组测序分析,他们发现TBK1i与免疫检查点抑制剂联用处理的小鼠肿瘤中,髓系细胞扩增显著增加,特别是促炎症型巨噬细胞亚群(M1型巨噬细胞)丰度显著增加,而某些免疫抑制性髓系细胞类群显著减少,如髓系来源的抑制细胞(MDSCs)。
抑制TBK1重塑肿瘤免疫微环境
他们还发现,TBK1i与免疫检查点抑制剂联用,会导致髓系细胞中与TNFα/NF-kβ信号通路和炎症反应相关的基因表达升高,如Tnf和Il1α。
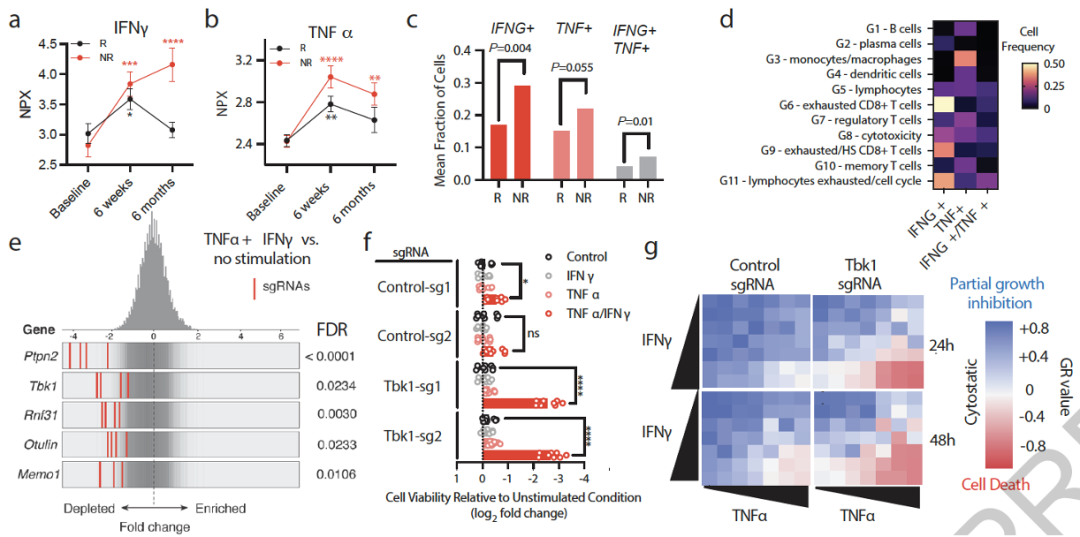
接下来,他们对203名转移性黑色素瘤患者进行了队列分析,发现在进行免疫检查点抑制剂疗法后6周,肿瘤患者血液中抗肿瘤免疫疗法的核心效应细胞因子TNFα和IFNγ水平都有所上升。
值得注意的是,缺失Tbk1的小鼠肿瘤细胞对于TNFα和IFNγ的敏感性增强,并且在人类黑色素瘤细胞系和患者来源的肿瘤模型(包括PDOTS和类器官)中,TBK1i处理也可以促进TNFα和IFNγ的细胞毒性。
抑制TBK1增强肿瘤细胞对于TNFa和IFNg的敏感性
为什么抑制TBK1可以促进TNFα和IFNγ的细胞毒性呢?
已有研究发现TBK1可以通过磷酸化RIPK1来抑制TNF受体下游的细胞死亡信号通路[3],通过免疫印记实验,他们发现TNFα和IFNγ处理后,缺失Tbk1的黑色素瘤细胞中磷酸化的RIPK1水平上升,细胞死亡标志物也伴随出现。
抑制RIPK1或者抑制细胞死亡效应因子(caspase 3)可以部分抑制TNFα和IFNγ诱导的Tbk1缺失黑色素瘤细胞死亡,而同时抑制RIPK1和caspase 3可以完全抑制TNFα和IFNγ诱导的Tbk1缺失黑色素瘤细胞死亡。
因此,抑制TBK1会通过影响细胞死亡通路,增强肿瘤细胞对于TNFα和IFNγ的敏感性。而且他们还发现,IFNγ感应通路对于抑制TBK1导致的肿瘤细胞对于TNFα/IFNγ的敏感性是必需的。
抑制TBK1增强肿瘤细胞对癌症免疫疗法的敏感性
总的来说,这项研究发现,TBK1是一个新的免疫逃逸基因,抑制TBK1可以通过增强肿瘤细胞对于效应细胞因子的敏感性,诱导细胞死亡,从而促进癌症免疫疗法的疗效。
此外,这个研究为克服癌症免疫疗法抗性提供了一个新的思路和靶点,TBK1抑制剂与免疫检查点抑制剂联用有潜力成为有效的治疗癌症的措施。
参考文献:
1.Sun, Y., et al., Targeting TBK1 to overcome resistance to cancer immunotherapy. Nature, 2023.
2.Manguso, R.T., et al., In vivo CRISPR screening identifies Ptpn2 as a cancer immunotherapy target. Nature, 2017. 547(7664): p. 413-418.
3.Xu, D., et al., TBK1 Suppresses RIPK1-Driven Apoptosis and Inflammation during Development and in Aging. Cell, 2018. 174(6): p. 1477-1491.e19.

本文地址://www.styjt.com/jiankang/2023-02-24/628874.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- 内蒙古煤矿坍塌事故调整救援方案 避免发生次生灾害影响2023-02-24 18:00:20
- 中央气象台:弱冷空气将影响华北东北2023-02-24 18:00:20
- 文化和旅游部:深化高校共建助推文化和旅游高质量发展2023-02-24 18:00:20
- 本轮疫情是否已经结束?官方最新研判2023-02-24 18:00:20
- 港深联合发布十六条措施促进跨境知识产权合作2023-02-24 18:00:20

 70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗
70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗2022-11-07

 梅婷现任70岁老公曾剑个人资料(曾剑个人资料)
梅婷现任70岁老公曾剑个人资料(曾剑个人资料)2022-09-08
- 烟台今天已封闭的小区 烟台现在封闭小区名单有哪些
2022-10-12 09:07:30
- 张家界桑植新娘吴梅婚纱照事件完整版 看女主出轨聊天内容视频
2022-11-11 14:27:00
- 目前南岸区及江北封闭小区名单有哪些 看最新封控通告
2022-11-11 14:49:26
- 无人售货机功能(无人自动售货机操作方法介绍)
2022-07-27 08:41:09
- 2022南宁封控小区名单表 南宁最新封闭小区名单2022年8月什么情况
2022-08-26 09:52:30