潜在首个!预防视网膜脱落新药获FDA优先审评
- 2023-03-04 08:00:25 健康一线
- 健康
3月2日,Aldeyra宣布FDA已受理ADX-2191(甲氨蝶呤)用于预防增殖性玻璃体视网膜病变(PVR)的新药申请(NDA),并授予其优先审评资格。PDUFA日期为2023年6月21日。
增殖性玻璃体视网膜病变是一种罕见的眼部炎症疾病,可以导致严重的视网膜瘢痕甚至失明,也是导致视网膜复位手术失败的主要原因。在美国,每年约有4000例患者,目前该疾病仍无相关疗法获批上市。
ADX-2191是一款无菌、非复合型的氨甲蝶呤玻璃体内注射制剂,具有预防或治疗特定的罕见视网膜疾病的潜力,包含原发性玻璃体视网膜淋巴瘤(PVRL)、PVR、视网膜色素变性(RP)。该制剂配方不含防腐剂,与玻璃体相容,并在赋形剂成分、浓度、密度、渗透压、pH值、浓度与给药量上均进行了优化。该产品已获FDA授予孤儿药资格,用于预防PVR、治疗PVRL和RP。
本次上次申请主要是基于III期GUARD研究的积极数据。该研究Part A部分共纳入106例患者,旨在评估ADX-2191对比标准疗法预防PVR的疗效和安全性。
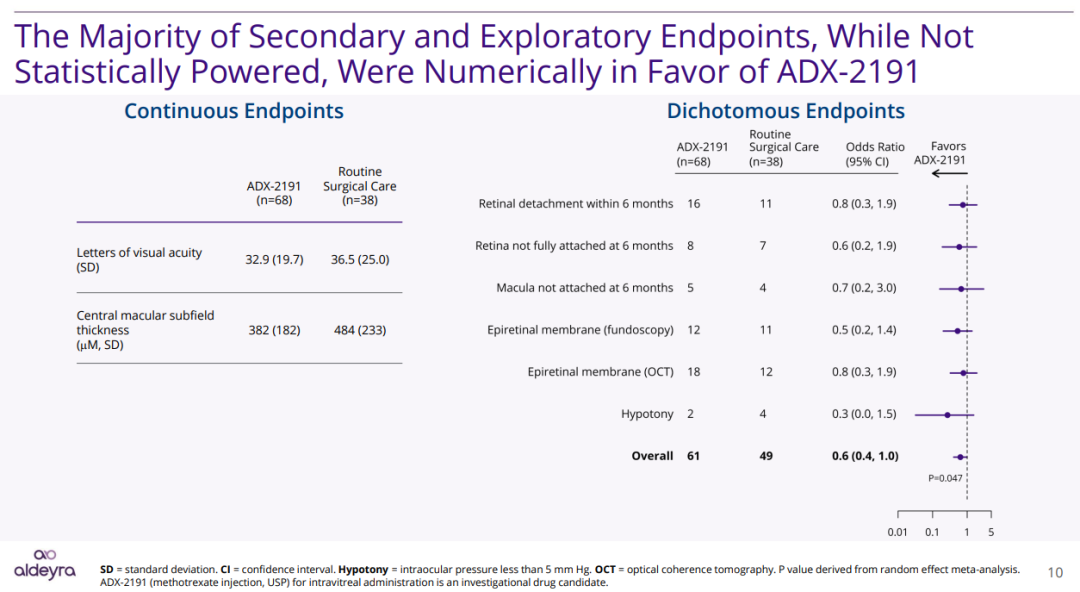
结果显示,在6个月内,ADX-2191组患者的视网膜脱落现象显著少于标准治疗组(P=0.024)。
此外,虽然该试验在其他的次要终点与探索终点上未有统计学意义的改善,但ADX-2191组的数值优于标准治疗组,其中包含低眼压、6个月的视网膜脱落速率二分终点、完全视网膜脱落、黄斑附着与视网膜前膜生成(总P值=0.047)。两组患者的视力相似,ADX-2191组患者的中央黄斑厚度小于标准治疗组。
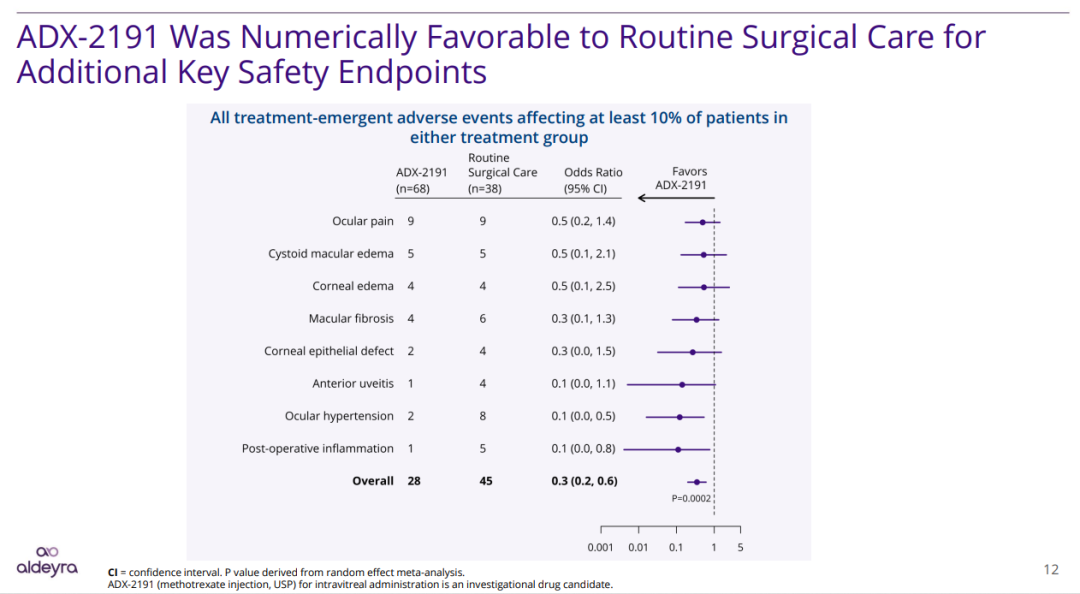
此外,ADX-2191的安全性与耐受性良好,没有观察到治疗相关严重不良反应(TESAE)。ADX-2191最常见的不良反应为点状角膜炎,这是玻璃体注射氨甲蝶呤时常见的不良反应,多为轻度。
Aldeyra总裁兼首席执行官Todd C. Brady博士表示:“FDA决定授予优先审查,并在NDA接受四个月后确定PDUFA日期,这体现了原发性玻璃体视网膜淋巴癌的巨大未满足临床需求。我们正与FDA密切合作,以尽快将ADX-2191带给患者。如果顺利获批,公司将于今年下半年在美国推出ADX-2191。”

本文地址://www.styjt.com/jiankang/2023-03-04/630420.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- 什么是蕈样肉芽肿2023-03-04 08:46:02
- 什么是轮状病毒腹泻2023-03-04 08:46:01
- 厌奶期是什么时候2023-03-04 08:46:00
- 喉咙难以下咽怎么回事2023-03-04 08:45:58
- 呼啦圈能减肥吗2023-03-04 08:45:57

 70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗
70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗2022-11-07

 梅婷现任70岁老公曾剑个人资料(曾剑个人资料)
梅婷现任70岁老公曾剑个人资料(曾剑个人资料)2022-09-08
- 烟台今天已封闭的小区 烟台现在封闭小区名单有哪些
2022-10-12 09:07:30
- 张家界桑植新娘吴梅婚纱照事件完整版 看女主出轨聊天内容视频
2022-11-11 14:27:00
- 目前南岸区及江北封闭小区名单有哪些 看最新封控通告
2022-11-11 14:49:26
- 无人售货机功能(无人自动售货机操作方法介绍)
2022-07-27 08:41:09
- 2022南宁封控小区名单表 南宁最新封闭小区名单2022年8月什么情况
2022-08-26 09:52:30