《胃肠病学》:兰州大学第二医院团队破解“癌王”对常用化疗药物耐药之谜!
- 2023-03-10 18:00:27 健康一线
- 健康
胰腺癌五年生存率仅为10%,素有“癌王”之称,而这与其存在普遍的治疗抵抗有很大关系[1]。
目前,化疗仍是胰腺癌治疗的主要方式,而吉西他滨又是这些化疗方案的“中流砥柱”,但吉西他滨存在严重的耐药性[2,3],导致大部分胰腺癌患者预后不良,因此,探究吉西他滨耐药机制对于改善胰腺癌生存就显得至关重要。
从机制上讲,吉西他滨最进入细胞后会转化为三磷酸核苷(dFdCTP),dFdCTP可与嘧啶核苷酸代谢产物dCTP竞争性结合DNA,导致DNA复制受阻[4,5]。而DNA复制受阻导致的复制应激,可再次增强吉西他滨的敏感性[6]。因此,靶向嘧啶代谢及复制应激,或许是克服胰腺癌吉西他滨耐药的有效策略。
近日,由兰州大学第二医院焦作义教授领衔的研究团队,在Gastroenterology发表了一项重要研究成果[7]。
这项研究发现,泛素结合酶UBE2T通过与泛素连接酶RING1相互作用,激活了p53泛素化降解,促进嘧啶代谢限速酶RRM1及RRM2的上调,削弱了吉西他滨诱导的复制应激,导致胰腺癌吉西他滨耐药。
好消息是,他们发现UBE2T抑制剂天然化合物PGG联合吉西他滨可显著抑制肿瘤生长,并延长胰腺癌小鼠生存。这意味着,胰腺癌对化疗耐药或许有了新的破解策略。
文章封面截图
在2021年,焦作义团队就发现泛素结合酶UBE2T在多种消化系统肿瘤中异常表达[8],尤其是在胰腺癌中表达差异最为显著。
为解析UBE2T在胰腺癌中的特定生物学功能,焦作义团队通过基于TCGA数据库的基因富集分析(GSEA),发现UBE2T在胰腺癌样本中富集最明显的通路为嘧啶代谢。
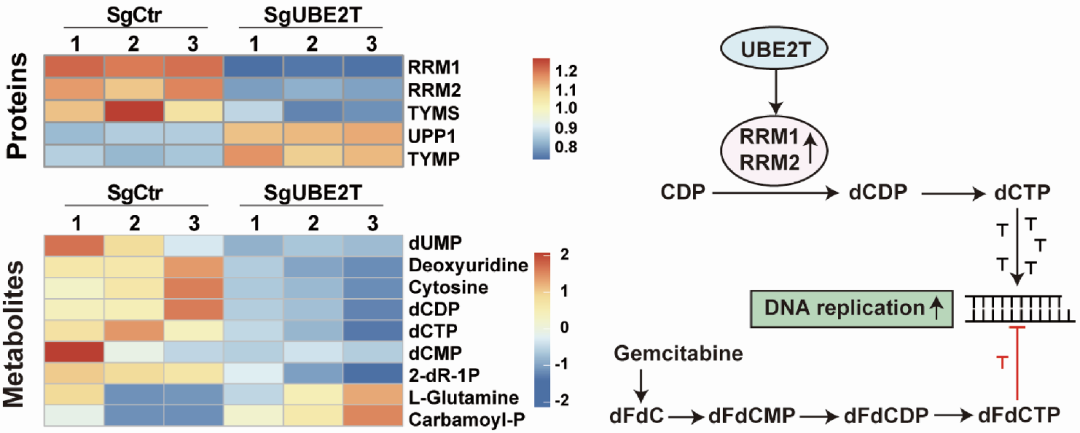
随后,他们通过蛋白代谢联合组学,进一步明确了UBE2T对嘧啶代谢通路的影响。发现UBE2T敲除后核苷酸还原酶RRM1和RRM2,以及其下游代谢物dCDP和dCTP显著下调(图1)。而dCTP合成又与吉西他滨敏感性密切相关,因此,他们猜测UBE2T可能介导了胰腺癌对吉西他滨的耐药。
图1. UBE2T敲除后对嘧啶代谢通路的影响
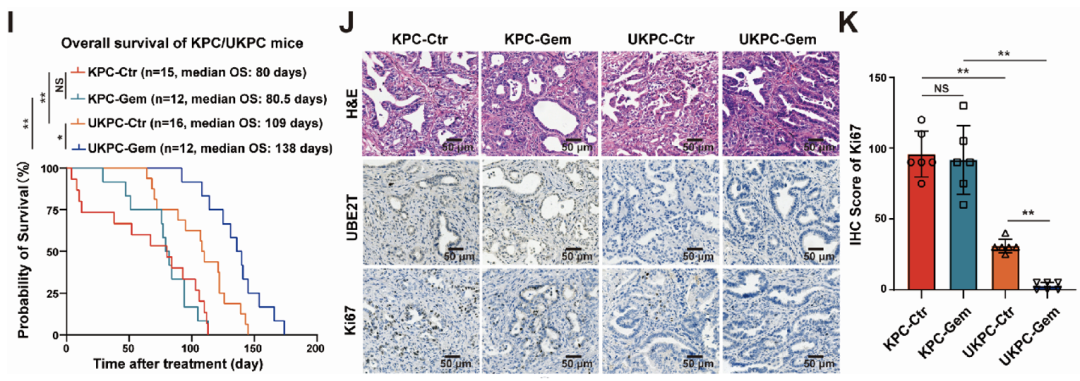
为明确UBE2T对吉西他滨治疗效果的影响,焦作义团队构建了UBE2T条件性敲除的胰腺癌基因工程鼠,并给予吉西他滨治疗。
结果表明,相比于野生型胰腺癌小鼠(KPC),UBE2T条件性敲除的胰腺癌小鼠(UKPC)生存时间更长(中位生存时间:138天 vs 80.5天)(图2I),且UKPC肿瘤组织中ki67蛋白水平也显著下调(图2J,K)。
由此可见,UBE2T在胰腺癌吉西他滨耐药中发挥了重要作用。
图2. UBE2T敲除对吉西他滨治疗效果的影响
随后,焦作义团队构建了人源胰腺癌类器官,检测了类器官中UBE2T蛋白水平,同时检测了类器官对吉西他滨的敏感性。结果表明,UBE2T蛋白水平与类器官对吉西他滨的敏感性呈负相关。此外,他们分析108例的临床胰腺癌组织样本发现,UBE2T预测胰腺癌患者对吉西他滨耐药的ROC值为0.877。
考虑到泛素结合酶UBE2T主要通过其泛素化活性发挥作用,他们于类器官中分别过表达了野生型(WT)及活性位点突变型(C86A)的UBE2T,并给予吉西他滨治疗。
结果显示,WT-UBE2T过表达组的类器官相比于对照组及C86A-UBE2T过表达组的类器官,具有更高的吉西他滨抗性(图3)。也就是说,UBE2T是通过其泛素化活性,促进了胰腺癌吉西他滨耐药。
图3. UBE2T活性位点对吉西他滨耐药性的影响
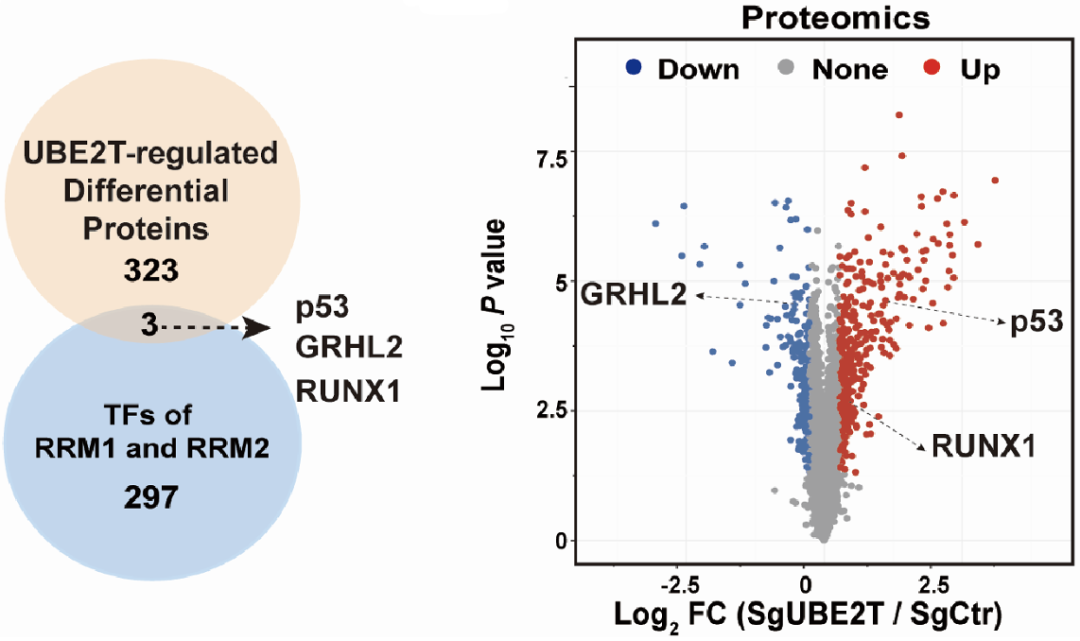
为明确UBE2T促进胰腺癌吉西他滨耐药的分子机制,焦作义团队检测了UBE2T对RRM1/2的调控作用,发现UBE2T同时上调了RRM1/2的mRNA及蛋白水平,且依赖于其泛素化活性。但UBE2T对RRM1/2并没有直接的泛素化调控作用,因此,他们假设UBE2T调控了RRM1及RRM2的转录因子。
随后,他们求取了RRM1/2转录因子及UBE2T调控的差异蛋白的集合,得到p53、GRHL2及RUNX1三个候选转录因子(图4)。经验证,GRHL2及RUNX1虽可调控RRM1/2,但却与UBE2T对RRM1/2的作用相互独立,而UBE2T可通过下调p53蛋白水平,促进RRM1/2的转录激活。
图4. UBE2T对RRM1/2待选转录因子的调控
基于以上数据及假设,焦作义团队进一步研究了UBE2T对p53的调控作用,发现UBE2T可通过结合泛素结合酶RING1,促进对p53的泛素化降解,从而激活RRM1/2的转录,促进嘧啶核苷酸的合成,减弱吉西他滨诱导的复制应激反应,削弱其治疗效果。
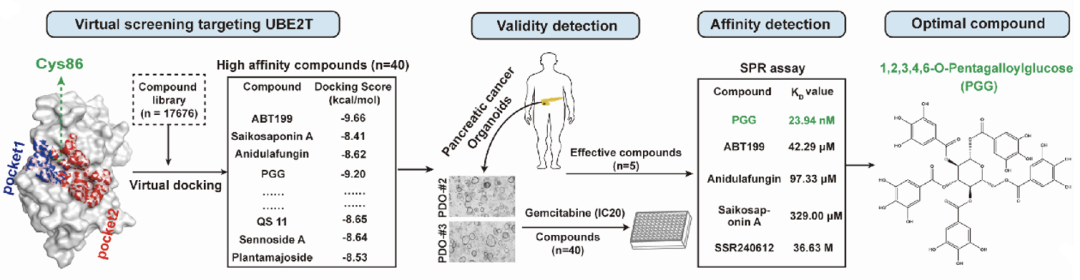
为开发出可克服胰腺癌对吉西他滨耐药的治疗策略,他们通过虚拟对接技术对17676个小分子进行了分子对接,并综合结合分数、骨架结构等多种因素最后筛选出排名前40的小分子。
接下来,他们通过类器官高通量检测筛选出5个可高效增敏吉西他滨的小分子化合物,同时检测了这5个小分子与UBE2T的亲和力。结果表明,在这些小分子中,天然化合物1,2,3,4,6-O-Pentagalloylglucose(PGG)不仅具备较强的吉西他滨增敏能力,也有着较强的UBE2T亲和力(图5)。
图5. UBE2T对RRM1/2待选转录因子的调控
焦作义团队进一步发现PGG可有效抑制UBE2T对p53的泛素化降解,上调RRM1及RRM2,并上调复制应激标志物γ-H2AX蛋白水平。简单来说,PGG可通过抑制UBE2T泛素化活性,抑制嘧啶核苷酸合成代谢,并增强吉西他滨诱导的复制应激反应。
那这种靶向UBE2T的治疗策略可否有效增强吉西他滨的治疗效果呢?
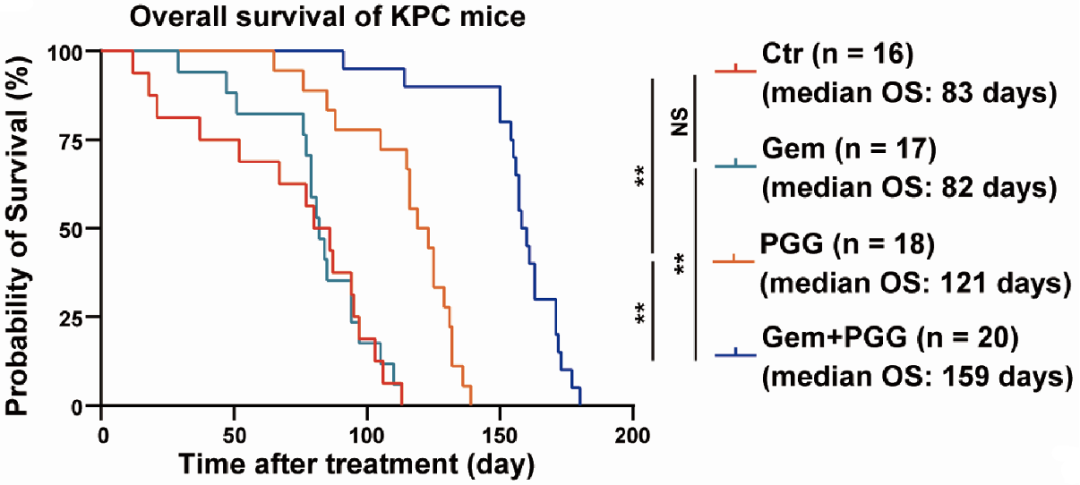
他们构建了模拟人类胰腺癌进展过程的KPC小鼠,以及可反应患者治疗反应的PDX模型,发现PGG联合吉西他滨的组合治疗可显著延长KPC小鼠的生存时间(159天 vs 83天)(图6),且显著抑制了PDX小鼠肿瘤的生长。
图6. PGG联合吉西他滨可显著延长KPC小鼠的生存时间
总的来说,这项研究揭示了UBE2T介导的泛素化,促进胰腺癌吉西他滨耐药的分子机制,并开发出了一种靶向UBE2T的小分子抑制剂,为胰腺癌治疗提供了新方法。
参考文献
1. Park W, Chawla A, O'Reilly EM. Pancreatic Cancer: A Review. JAMA. 2021 Sep 7;326(9):851-862. doi: 10.1001/jama.2021.13027.
2. Neoptolemos JP, Kleeff J, Michl P, et al. Therapeutic developments in pancreatic cancer: current and future perspectives. Nat Rev Gastroenterol Hepatol. 2018 Jun;15(6):333-348. doi: 10.1038/s41575-018-0005-x.
3. Wang Y, Yang G, You L, et al. Role of the microbiome in occurrence, development and treatment of pancreatic cancer. Mol Cancer. 2019 Dec 1;18(1):173. doi: 10.1186/s12943-019-1103-2.
4. Binenbaum Y, Na'ara S, Gil Z. Gemcitabine resistance in pancreatic ductal adenocarcinoma. Drug Resist Updat. 2015 Nov;23:55-68. doi: 10.1016/j.drup.2015.10.002.
5. Liang C, Shi S, Meng Q, et al. Complex roles of the stroma in the intrinsic resistance to gemcitabine in pancreatic cancer: where we are and where we are going. Exp Mol Med. 2017 Dec 1;49(12):e406. doi: 10.1038/emm.2017.255.
6. Smith SC, Petrova AV, Madden MZ, et al. A gemcitabine sensitivity screen identifies a role for NEK9 in the replication stress response. Nucleic Acids Res. 2014 Oct;42(18):11517-27. doi: 10.1093/nar/gku840.
7. Jiang X, Ma Y, Wang T, et al. Targeting UBE2T potentiates gemcitabine efficacy in pancreatic cancer by regulating pyrimidine metabolism and replication stress. Gastroenterology. 2023 Feb 24:S0016-5085(23)00164-6. doi: 10.1053/j.gastro.2023.02.025.
8. Yu Z, Jiang X, Qin L, et al. A novel UBE2T inhibitor suppresses Wnt/β-catenin signaling hyperactivation and gastric cancer progression by blocking RACK1 ubiquitination. Oncogene. 2021 Feb;40(5):1027-1042. doi: 10.1038/s41388-020-01572-w.

本文地址://www.styjt.com/jiankang/2023-03-10/631711.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- 专家:大部分地区气温偏暖对农业生产利大于弊2023-03-10 18:00:36
- 河北多地气温破3月上旬最高纪录 民众称“快进到夏天”2023-03-10 18:00:35
- 国家医保局:2022年底职工基本医疗保险人数同比增长2.3%2023-03-10 18:00:35
- 2022年度个税汇算已启动 四方面新变化需注意2023-03-10 18:00:34
- 天津多措并举推动京津冀金融协同发展2023-03-10 18:00:34

 70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗
70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗2022-11-07

 梅婷现任70岁老公曾剑个人资料(曾剑个人资料)
梅婷现任70岁老公曾剑个人资料(曾剑个人资料)2022-09-08
- 烟台今天已封闭的小区 烟台现在封闭小区名单有哪些
2022-10-12 09:07:30
- 张家界桑植新娘吴梅婚纱照事件完整版 看女主出轨聊天内容视频
2022-11-11 14:27:00
- 目前南岸区及江北封闭小区名单有哪些 看最新封控通告
2022-11-11 14:49:26
- 无人售货机功能(无人自动售货机操作方法介绍)
2022-07-27 08:41:09
- 2022南宁封控小区名单表 南宁最新封闭小区名单2022年8月什么情况
2022-08-26 09:52:30