科研人员发展了蛋白质关键别构残基预测方法
- 2023-03-20 18:00:24 健康一线
- 健康
别构调控在酶催化、信号传导等多种生物学过程中发挥着重要作用。与传统的作用于生物功能位点的正构药物相比,别构药物由于具有更高的特异性、更少的副作用以及能有效克服已有的耐药性突变等独特优势而受到广泛关注。但是别构分子与靶标蛋白之间更高的结合亲和力常常并不对应着更好的活性,因此别构分子的优化面临着很大的挑战。在别构位点中,各残基对别构效应的贡献有所不同,其中的关键残基决定了别构信号的传导方向和强度,而其它残基则主要起到辅助结合作用。找出别构位点中主要负责别构信号传导的残基(关键别构残基)对理解别构调控机制、开展功能蛋白质与药物设计具有重要意义。目前还没有能够预测关键别构残基的有效方法。
北京大学化学与分子工程学院/前沿交叉学科研究院定量生物学中心来鲁华教授课题组、北京大学前沿交叉学科研究院定量生物学中心/数学科学学院邓明华教授课题组和安徽农业大学理学院祝小雷副教授课题组合作应用进化耦合模型对残基之间的共进化进行分析,发现蛋白质的正构位点和别构位点之间存在进化耦合,蛋白质序列上的弱共进化耦合项包含蛋白质功能信息。在此基础上作者发展了首个预测关键别构残基的计算方法KeyAlloSite,为别构药物的设计和优化、功能蛋白质设计等研究提供了有用的工具。相关研究近日发表在eLife上。
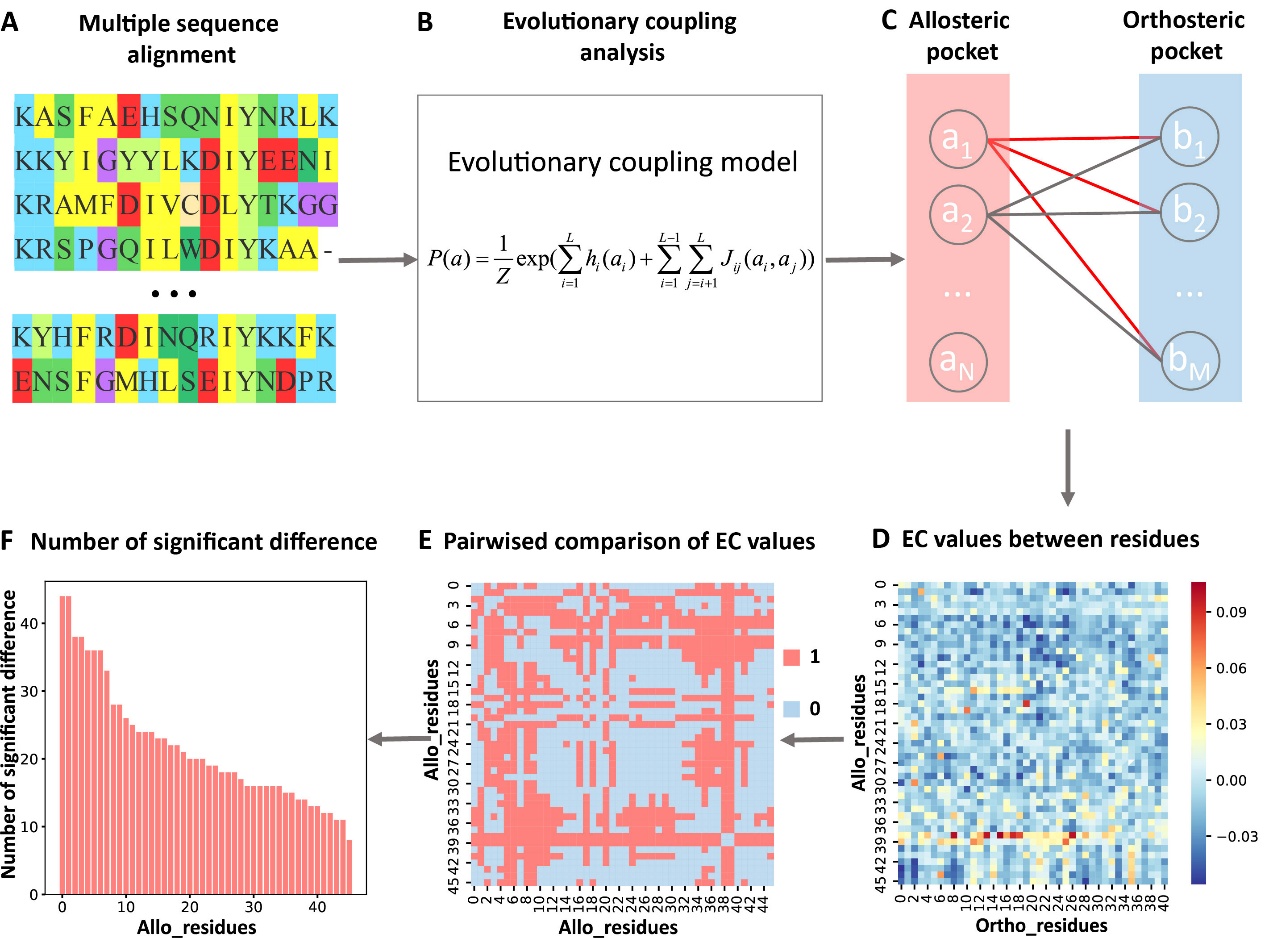
在进化过程中,蛋白质中残基之间的功能耦合会驱动它们的共进化,而共进化的模式可以从多序列比对中获得。由于别构位点能够影响正构位点的功能,对于别构蛋白质数据集中的每个蛋白,作者首先利用进化耦合模型分析了正构口袋和别构口袋以及其它口袋之间的共进化耦合强度,并将共进化耦合强度归一化成Z-score。然后根据Z-score对别构口袋和其它口袋进行排序。研究发现92%的已知别构位点对应的Z-score都大于0.5,已知别构位点位于前3名的概率是96%,表明正构和别构口袋之间的共进化耦合强度强于正构和其它非功能口袋之间的进化耦合强度。
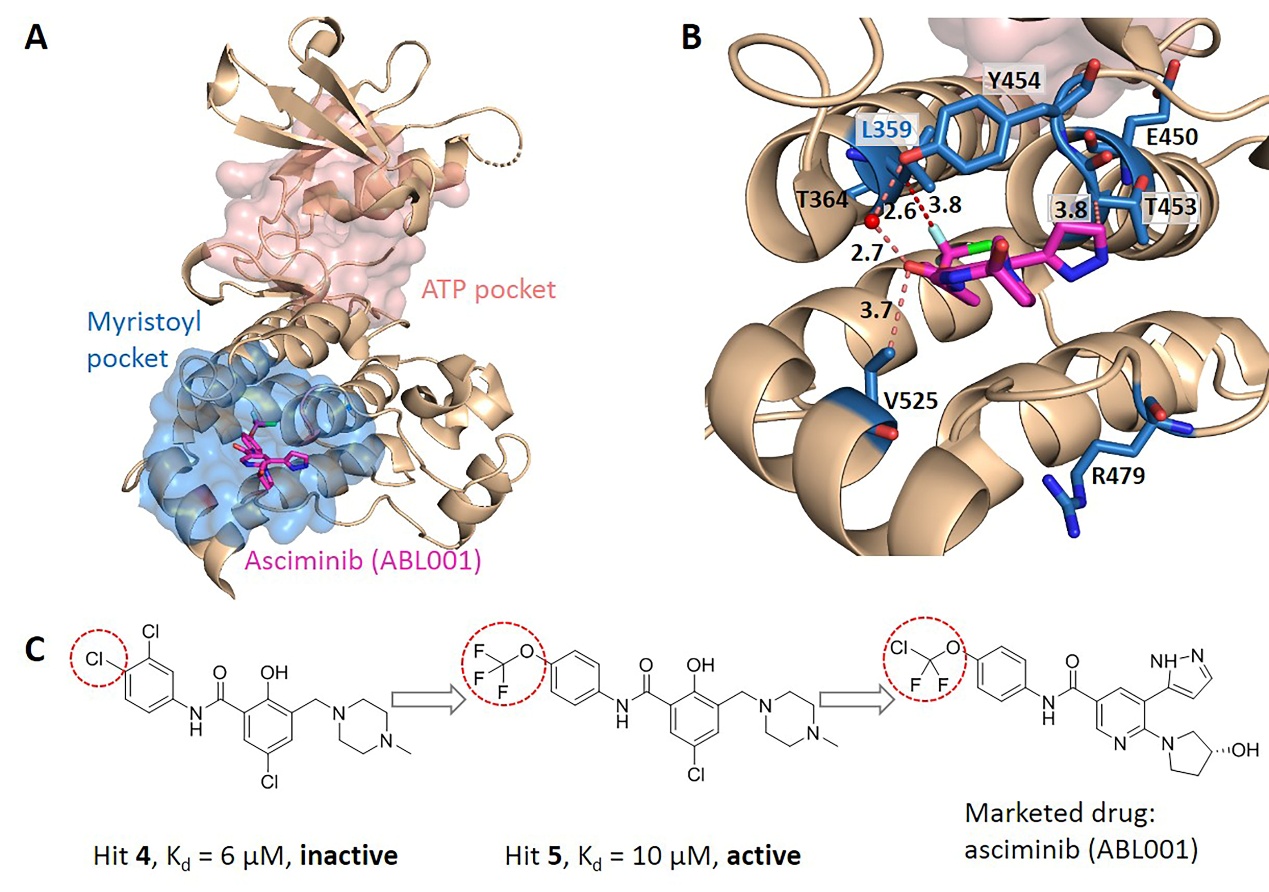
进一步通过两两比较别构口袋中的残基对应的进化耦合值之间的差异,推出别构口袋中的每个残基对应的显著性差异数,将残基对应的显著性差异数归一化为Z-score进行关键别构残基预测(图1)。KeyAlloSite预测的关键别构残基与多个蛋白质体系中的实验结果相一致。例如,在酪氨酸蛋白激酶ABL1(BCR-ABL1)中,KeyAlloSite预测的关键别构残基L359在别构信号传导中起着关键作用。当别构分子hit 4和L359之间没有相互作用时,hit 4尽管结合较强但是没有活性。别构分子hit 5由于和L359之间存在有利的疏水相互作用,所以尽管和hit 4相比结合亲和力更弱,但具有酶抑制活性(图2)。
图1. 确定关键别构残基的步骤
图2. KeyAlloSite在BCR-ABL1中预测的关键别构残基
KeyAlloSite还可以预测酶中远离酶的底物结合位点但是对酶的催化活性有很大影响的关键别构残基。例如,在南极假丝酵母脂肪酶B(Candida antarctica lipase B)中,KeyAlloSite预测的关键别构残基A225和V37对酶的活性非常重要,将A225突变成M能够将酶的催化效率提升11倍,将V37突变成I能够将酶的催化效率提升3倍。
北京大学前沿交叉学科研究院定量生物学中心博士后谢娟为该论文的第一作者,来鲁华为该论文的通讯作者,邓明华和祝小雷为该研究提供了关键指导和帮助,北京大学化学与分子工程学院张伟林博士后(已出站)参与了该研究工作。该研究得到了国家自然科学基金重点项目、中国医学科学院创新项目、北京分子科学国家研究中心和北京大学-清华大学生命科学联合中心的资助。
来鲁华课题组在蛋白质别构调控领域开展了系统研究,发展了系统性的别构药物设计方法并在多个体系中获得了别构活性化合物。他们的近期工作进一步揭示了蛋白质活性位点与别构位点在不同运动模式上的相关性,提高了基于蛋白质表面口袋及运动相关性分析的别构位点预测方法精度(J Chem Inf Mod 2022, 62, 187)。相关方法CorrSite2.0已整合进课题组发展的综合性蛋白质口袋分析在线计算服务器CavityPlus中(http://www.pkumdl.cn/cavityplus,Nucleic Acids Res, 2018, 46, W374),为蛋白质口袋分析、别构药物设计、功能预测等提供了计算工具。来鲁华课题组与化学学院刘志荣课题组合作揭示了别构调控与配体结合口袋受力分布的关系,第一次实现了蛋白质功能别构调控方向的预测,所发展的AlloType为蛋白质别构调控方向预测提供计算工具(J Phys Chem Lett 2021, 12, 5404);定量分析了动力学别构调控的贡献,揭示了熵驱动的动力学别构的本质(J Chem Inf Mod 2022, 62, 2538)。

本文地址://www.styjt.com/jiankang/2023-03-20/633042.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- 北京银保监局发布风险提示:警惕六类诈骗“陷阱”守住养老钱包2023-03-20 18:00:31
- 7月1日实施!电动自行车乘员头盔“强制性国家标准”来了2023-03-20 18:00:31
- 北京海淀:2848套共有产权房 今年11月交付使用2023-03-20 18:00:30
- 北京:今天白天多云转晴 最高气温18℃2023-03-20 18:00:30
- 中国海关总署:将持续完善跨境电商进出口退货措施2023-03-20 18:00:30

 70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗
70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗2022-11-07

 梅婷现任70岁老公曾剑个人资料(曾剑个人资料)
梅婷现任70岁老公曾剑个人资料(曾剑个人资料)2022-09-08
- 烟台今天已封闭的小区 烟台现在封闭小区名单有哪些
2022-10-12 09:07:30
- 张家界桑植新娘吴梅婚纱照事件完整版 看女主出轨聊天内容视频
2022-11-11 14:27:00
- 目前南岸区及江北封闭小区名单有哪些 看最新封控通告
2022-11-11 14:49:26
- 无人售货机功能(无人自动售货机操作方法介绍)
2022-07-27 08:41:09
- 2022南宁封控小区名单表 南宁最新封闭小区名单2022年8月什么情况
2022-08-26 09:52:30
文章排行榜
- 周排名
- 月排名
- 1应对儿童流感,除奥司他韦,还可选芩香清解口服液
- 2两会上的“控烟”之声:@3.5亿烟民,国产戒烟药或将成为拯救健康的第一步?
- 3艾尔建美学中国医美专家峰会聚焦“以求美者为中心” Going Beyond Beauty正式发布
- 4全国爱肝日,带你认识这几种累及肝脏的罕见病
- 5流感又凶变!陕西推荐成人和儿童使用连花清瘟治疗甲流
- 6眼底相机拍照+人工智能辅助诊断!上海探索青光眼社区慢病管理新模式
- 7治新冠抗甲流,连花清瘟异病同治获中西临床共证
- 8全球CRO普米尔医药与 InSilicoTrials Technologies 携手创建合成对照组优化罕见病疗法监管途径
- 9沈阳社保缴费基数上下限2023是多少?沈阳社保费用交多少钱?
- 10“中国医药企业研发指数”在京发布