《胃肠病学》:复旦中山医院等团队,发现增强肝癌免疫治疗效果的新方法!
- 2023-04-17 18:00:39 健康一线
- 健康
目前,免疫治疗已经成为晚期肝细胞癌(HCC)的重要治疗方案。
纳武利尤单抗[1]、阿替利珠单抗[2]等免疫检查点抑制剂(ICIs)为HCC患者带来一定的获益。
然而,不可否认的是,目前ICIs在HCC患者治疗中效果有限,不同患者对ICIs治疗敏感性差异较大,极大限制了ICIs在HCC患者中的临床应用。为突破这一瓶颈,迫切需要能够有效区分ICIs治疗敏感和耐药群体的生物标志物,来指导临床治疗。
既往研究发现,Schlafen(SLFN)家族蛋白在调节免疫细胞功能及肿瘤生物学进程中发挥重要作用[3]。2020年,复旦大学中山医院任宁团队发现,SLFN家族成员SLFN11可以通过RPS4X抑制HCC中的mTOR通路,来抑制HCC发生及转移[4]。然而,SLFN11在肿瘤免疫调控及ICIs治疗中的作用目前还不为我们所知。
近日,任宁团队联合台湾省中国医药大学洪明奇团队,在著名期刊Gastroenterology发表了最新的研究成果[5]。他们发现,SLFN11在对ICIs治疗敏感的HCC患者中显著上调。而SLFN11表达缺失诱导细胞因子CCL2表达,进而促进巨噬细胞向免疫抑制性的M2型极化,拮抗ICIs的治疗效应。
重要的是,本研究还发现,检测患者血清SLFN11水平,可作为判断ICIs治疗响应的有效指标。同时,靶向抑制CCL2的受体CCR2可作为ICIs的潜在联合治疗方式,拓展了ICIs在HCC治疗中的应用。复旦大学中山医院周晨浩和翁佳雷,以及美国MD安德森癌症中心的刘春晓为本研究的共同第一作者。
论文首页截图
接下来咱们就一起来看看这个研究是如何展开的。
研究人员首先对ICIs响应治疗和不响应的HCC患者肿瘤标本进行了转录组测序,结果发现SLFN11在响应治疗的患者中显著高表达,提示SLFN11可能是影响HCC患者ICIs治疗疗效的重要因素。
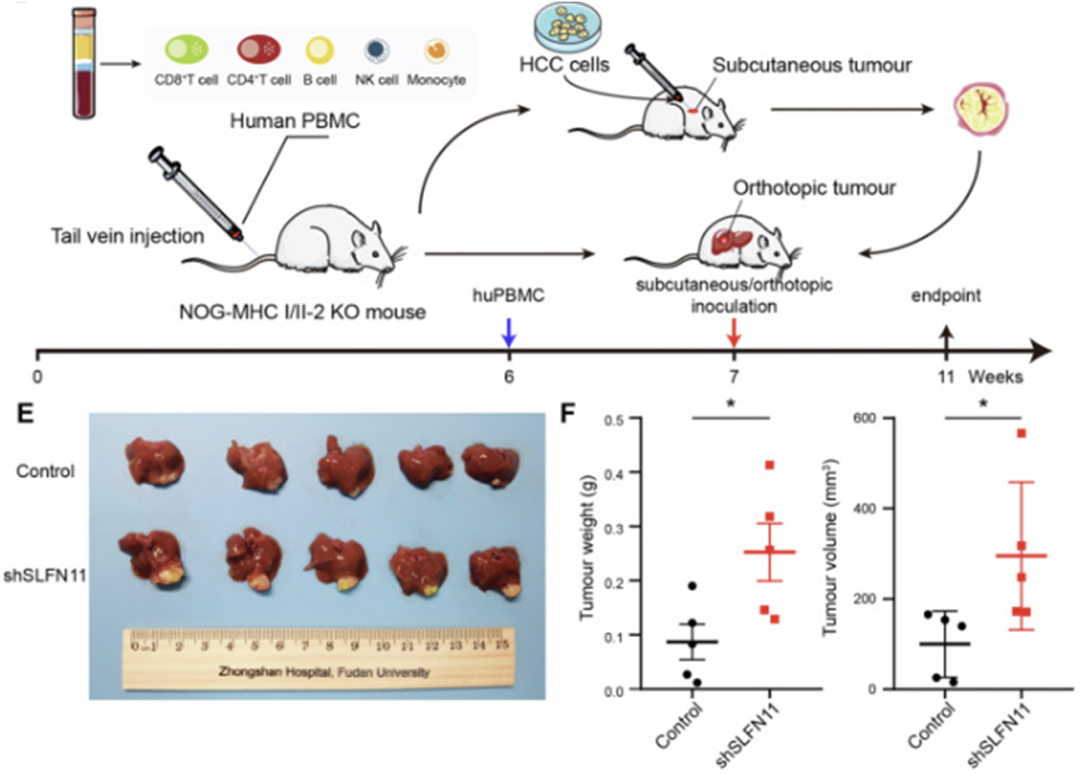
为了验证这一发现,研究人员构建了人源化HCC原位小鼠模型。结果发现,与对照组相比,SLFN11敲低组肿瘤体积更大,同时伴随有更多的转移灶形成,进而明确了SLFN11对HCC的抑制作用。
SLFN11抑制人源化HCC小鼠模型肿瘤生长
那么SLFN11是如何发挥上述作用的呢?
基于质谱流式技术,研究人员研究了SLFN11对不同免疫细胞的影响,其中在SLFN11缺失的肿瘤中免疫抑制性巨噬细胞浸润显著增加。
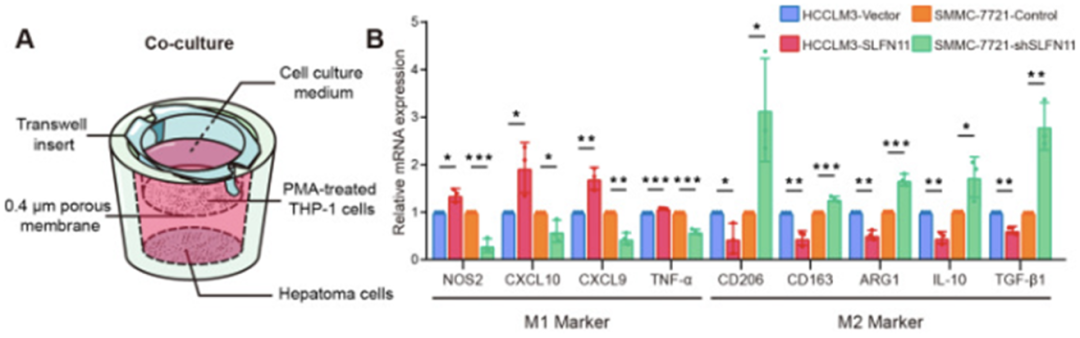
HCC细胞与佛波酯(PMA)诱导分化为巨噬细胞的THP-1人单核白血病细胞的共培养结果也显示,SLFN11表达缺失可以促进巨噬细胞的迁移和M2型极化。
SLFN11缺失诱导巨噬细胞M2型极化
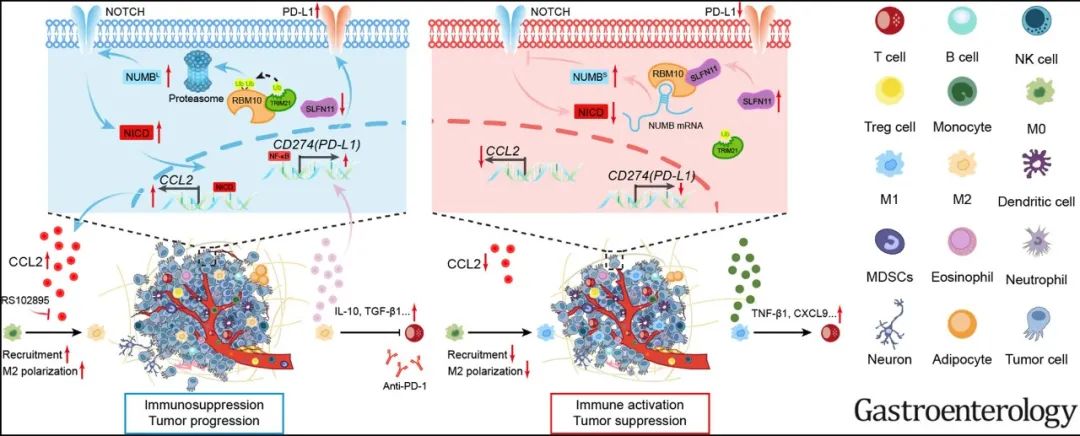
从机制上讲,SLFN11缺失会导致细胞因子CCL2水平显著升高,并进一步以CCL2依赖的方式促进巨噬细胞向M2型极化。
CCL2是一种多功能的分泌蛋白,CCR2是其受体。既往研究表明,CCL2/CCR2信号传导是巨噬细胞向M2型极化的重要调节因子[6],广泛参与肿瘤侵袭转移等恶性生物学行为[7]。在HCC中靶向抑制CCL2/CCR2通路,可干扰肿瘤细胞与巨噬细胞间的信号传递,抑制巨噬细胞极化,恢复正常抗肿瘤免疫[8]。
此外,研究人员还发现,SLFN11缺失诱导的巨噬细胞极化,可以通过NF-κB/p65通路上调HCC细胞中PD-L1的表达,进一步增强肿瘤免疫抑制,干扰ICIs治疗疗效,影响HCC患者预后。
研究机制图
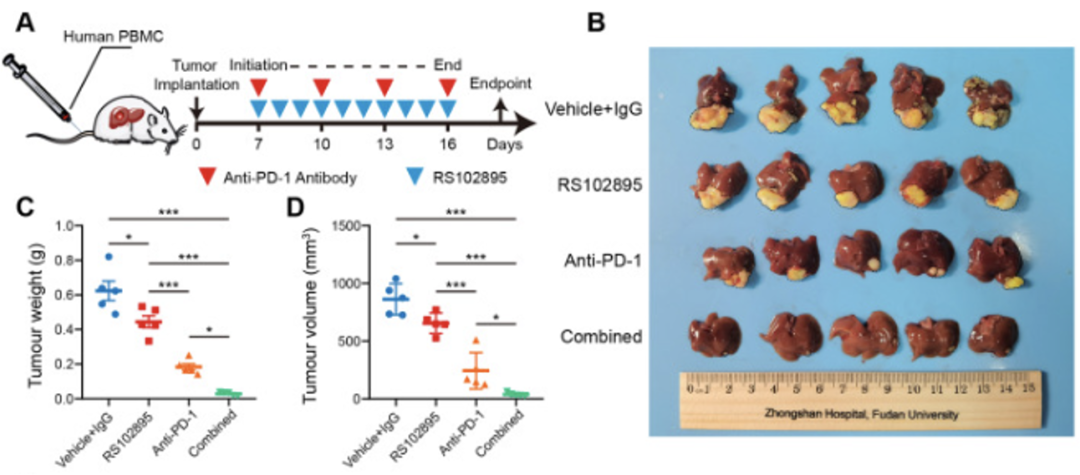
上述研究发现促使研究人员思考,阻断CCL2/CCR2信号传导来破坏肿瘤细胞与巨噬细胞间的通讯,是否可以提高PD-1抑制剂在HCC中的治疗效果。
通过人源化HCC小鼠模型发现,与单一用药相比,CCR2拮抗剂与PD-1抑制剂具有明显的协同效应。免疫组化分析也表明,联合治疗组肿瘤组织具有更为明显的“热”肿瘤特征,提示与CCR2拮抗剂联用可能是增强PD-1抑制剂治疗疗效的潜在方式。
CCR2拮抗剂与PD-1阻断剂联用具有协同治疗效应
最后,研究人员还分析了SLFN11作为预测HCC患者ICIs响应治疗生物标志物的应用价值。通过检测患者血清SLFN11水平,他们发现,对PD-1抑制剂治疗有反应的HCC患者血清SLFN11水平明显高于无应答者,而且这一结果也可以外推到尿路上皮癌等其他肿瘤患者,证明了血清SLFN11作为预测性标志物的潜在应用价值。
总的来说,本研究揭示了HCC中SLFN11参与巨噬细胞重编程以及肿瘤免疫逃逸的机制,证明了SLFN11作为ICIs治疗反应预测性生物标志物的应用价值,并且创新性地提出靶向CCL2/CCR2通路是HCC患者ICIs的联合治疗新策略,为HCC患者的个体化治疗以及疗效提升具有重要应用价值,同时也为后续靶向巨噬细胞的治疗策略开发提供了参考。
参考文献:
[1]El-Khoueiry AB, Sangro B, Yau T, et al. Nivolumab in patients with advanced hepatocellular carcinoma (CheckMate 040): an open-label, non-comparative, phase 1/2 dose escalation and expansion trial[J]. Lancet, 2017, 389 (10088):2492-2502. DOI:10.1016/s0140-6736(17)31046-2.
[2]Finn RS, Qin S, Ikeda M, et al. Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma[J]. N Engl J Med, 2020, 382 (20):1894-1905. DOI:10.1056/NEJMoa1915745.
[3]Liu F, Zhou P, Wang Q, et al. The Schlafen family: complex roles in different cell types and virus replication[J]. Cell Biol Int, 2018, 42 (1):2-8. DOI:10.1002/cbin.10778.
[4]Zhou C, Liu C, Liu W, et al. SLFN11 inhibits hepatocellular carcinoma tumorigenesis and metastasis by targeting RPS4X via mTOR pathway[J]. Theranostics, 2020, 10 (10):4627-4643. DOI:10.7150/thno.42869.
[5]Zhou C, Weng J, Liu C, et al. Disruption of SLFN11 Deficiency-Induced CCL2 Signaling and Macrophage M2 Polarization Potentiates Anti-PD-1 Therapy Efficacy in Hepatocellular Carcinoma[J]. Gastroenterology, 2023. DOI:10.1053/j.gastro.2023.02.005.
[6]Sierra-Filardi E, Nieto C, Domínguez-Soto A, et al. CCL2 shapes macrophage polarization by GM-CSF and M-CSF: identification of CCL2/CCR2-dependent gene expression profile[J]. J Immunol, 2014, 192 (8):3858-3867. DOI:10.4049/jimmunol.1302821.
[7]Zhang J, Patel L,Pienta KJ. Targeting chemokine (C-C motif) ligand 2 (CCL2) as an example of translation of cancer molecular biology to the clinic[J]. Prog Mol Biol Transl Sci, 2010, 95:31-53. DOI:10.1016/b978-0-12-385071-3.00003-4.
[8]Li X, Yao W, Yuan Y, et al. Targeting of tumour-infiltrating macrophages via CCL2/CCR2 signalling as a therapeutic strategy against hepatocellular carcinoma[J]. Gut, 2017, 66 (1):157-167. DOI:10.1136/gutjnl-2015-310514.

本文地址://www.styjt.com/jiankang/2023-04-17/637580.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- EHPM:摄入加工红肉或会增加机体患急性髓性白血病和骨髓增生异常综合征的风险2023-04-17 18:00:43
- BMJ:空气污染或会增加机体患痴呆症的风险2023-04-17 18:00:42
- Immunity:IgG抑制炎症性骨重建需要模式识别受体Dectin-12023-04-17 18:00:42
- Nature Nanotechnology:樊春海、左小磊团队基于框架核酸生物传感的多维分子分型研究取得进展2023-04-17 18:00:41
- 研究发现一种致病性遗传变异可能增加胃癌患病风险2023-04-17 18:00:40

 70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗
70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗2022-11-07

 梅婷现任70岁老公曾剑个人资料(曾剑个人资料)
梅婷现任70岁老公曾剑个人资料(曾剑个人资料)2022-09-08
- 烟台今天已封闭的小区 烟台现在封闭小区名单有哪些
2022-10-12 09:07:30
- 张家界桑植新娘吴梅婚纱照事件完整版 看女主出轨聊天内容视频
2022-11-11 14:27:00
- 无人售货机功能(无人自动售货机操作方法介绍)
2022-07-27 08:41:09
- 目前南岸区及江北封闭小区名单有哪些 看最新封控通告
2022-11-11 14:49:26
- 2022南宁封控小区名单表 南宁最新封闭小区名单2022年8月什么情况
2022-08-26 09:52:30
文章排行榜
- 周排名
- 月排名
- 1预防治疗 人人可及 ——2023年云南省世界血友病日纪念活动圆满落幕
- 2迈迪思创提供临床试验服务 两款三类IVD产品通过国家局审批
- 3关爱血友病儿,健康茁壮成长—— 复旦大学附属儿科医院2023年世界血友病日暨血友病俱乐部活动顺利举行
- 4聚焦算力 助推数智转型: 惠普成功举办Z系列工作站客户顾问委员会大会
- 5比利时专家发文引用中国楚雄州医院骨二科科研成果
- 62023“创•在上海”国际创新创业生物医药专题赛——上海(南翔)医学产业园分赛点圆满收官
- 72023年养老金将在7月前调整到位?退休人员能补发多少?有500元以上吗?
- 8政法委干部勇救落水女孩 网友点赞称其“黑衣侠”
- 9科学抗衰老 由内而外年轻态 丨“八子抗衰老百城科普公益行”正式启动
- 10抗衰老新途径!八子补肾胶囊抗衰老研究成果亮相2023乌镇健康大会