《自然·癌症》:在肺部沉睡多年的乳腺癌细胞为何会突然苏醒?科学家发现衰老相关的微环境是关键
- 2023-04-19 18:00:26 健康一线
- 健康
肿瘤转移是乳腺癌致死的最常见原因,在初次诊断后的10-32年期间,晚期乳腺癌复发率为15.53%,在第32年时累积复发率为16.6%[1]。
雌激素受体(ER)阳性的乳腺癌占总病例数的70%左右,这种病理分型的乳腺癌可谓十分狡猾,虽然治疗初期预后较好,但是在治疗数十年后,仍然有较大的转移复发风险[2, 3]。
这是因为有少数休眠的播散肿瘤细胞(DTCs)持续存在,它们最初悄无声息地潜伏在原发灶以外的部位,一旦被重新激活,便进入增殖状态,最终形成转移灶。所以,探究微环境如何调控DTCs的生存和激活,对于防治乳腺癌的远期复发具有重要意义。
近日,由英国癌症研究院Clare Isacke领衔的研究团队,在著名期刊《自然·癌症》上发表论文,阐述了年龄相关的微环境变化调控ER阳性乳腺癌转移性复发的机制[4]。
他们发现,在年轻小鼠体内,DTCs低表达血小板源生长因子C(PDGF-C),有利于肿瘤细胞在原发灶以外部位存活,但不足以形成临床可见的转移灶;而在老年小鼠或纤维化的肺中,环境中高水平的PDGF-C可促进DTCs增殖,并上调肿瘤细胞的Pdgfc水平,从而促进疾病进展。
本研究揭示了微环境中PDGF-C调节肿瘤进展的新机制,并且为预防ER阳性乳腺癌的转移性复发,提供了可能的治疗靶点。
论文截图
研究肿瘤远期复发的调控机制,并不是一件容易的事。
要想用动物模型研究肿瘤复发,意味着不仅要在动物体内实现DTCs长期存活、不被免疫系统清除,还要短时间内不能成瘤、没有临床表现,等于是放个定时炸弹,还要求它不能立马爆炸,这实在是种很难达成的微妙平衡。
Isacke团队利用ER阳性乳腺癌的同系小鼠模型,将小鼠来源的肿瘤细胞移植到遗传背景一致、免疫功能健全的小鼠体内,成功实现了肺部定植,却又不形成大转移灶。
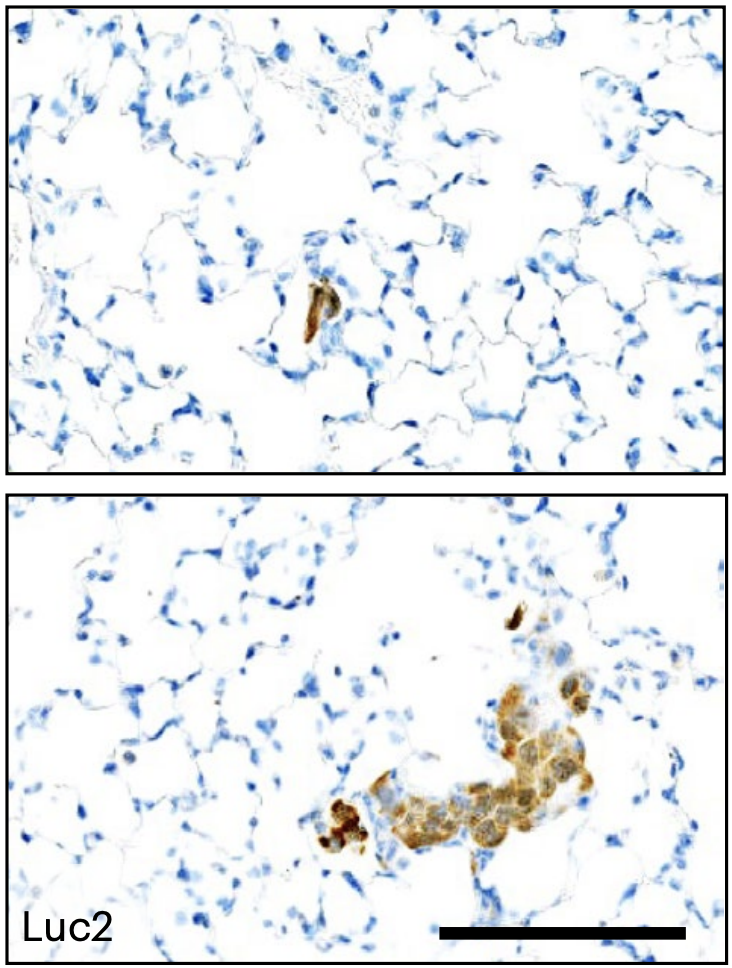
Isacke和他的同事注意到,在体外培养条件下,ER阳性的小鼠乳腺癌细胞系增殖不活跃,用ER阴性的乳腺癌细胞或正常肺成纤维细胞上清处理后,才能重新开始增殖;原位移植模型也不像ER阴性的细胞能形成明显的转移灶,在肺部和其他器官仅有单个DTCs,或形成小于10个细胞的细胞团。
ER阳性乳腺癌原位移植模型,肺部未见宏观转移
考虑到ER阳性乳腺癌长期潜伏的特点,研究人员推测,既然肿瘤可能在几十年后才有转移性复发,会不会是衰老在其中起作用?
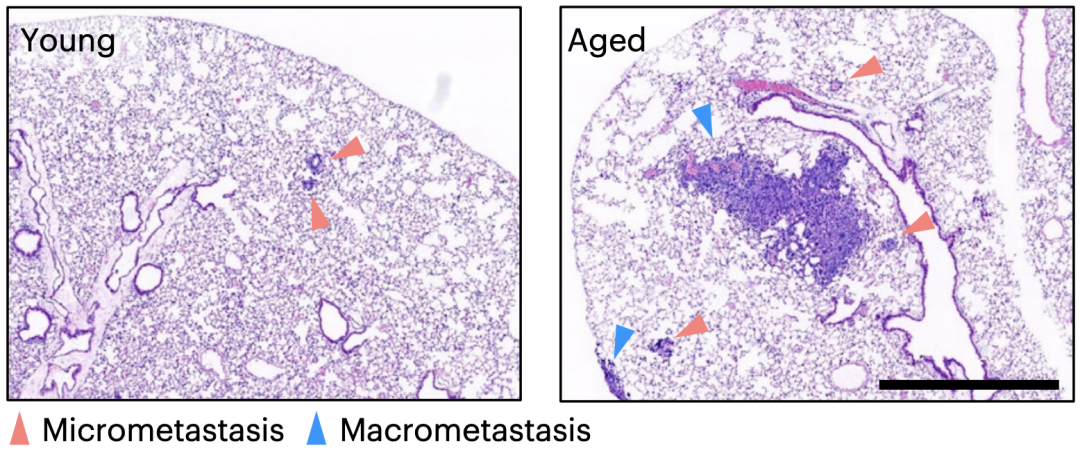
他们将年轻和年老小鼠模型进行了比较。在年轻小鼠体内,肺部的DTCs呈单个细胞或小细胞团形式,且只有极少数处于增殖状态;而在老年或纤维化的肺中,DTCs形成转移灶的能力更强。
年轻(左)与年老(右)小鼠的肺部转移情况
接下来,研究人员对年轻和年老小鼠的肺组织进行了RNA-seq分析,发现成纤维细胞激活以及纤维化相关的基因存在差异表达。于是他们又进一步探究了肺纤维化在ER阳性乳腺癌转移性复发中的作用。
果不其然,在肺纤维化的小鼠模型中,ER阳性乳腺癌细胞形成转移灶的能力显著增强。结合先前肺成纤维细胞培养上清可刺激ER阳性乳腺癌增殖的结果,研究人员推测老年小鼠体内某些促纤维化因子加速了转移灶的形成。
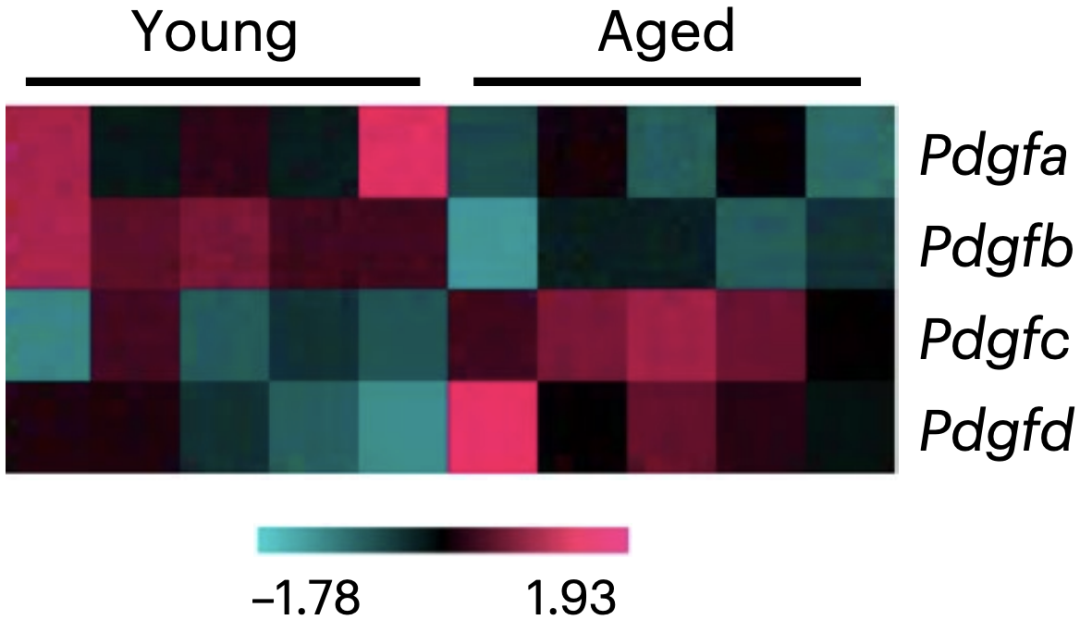
经分析,Isacke团队发现促纤维化的生长因子——PDGF家族的多个基因在年老和年轻小鼠肺部的表达模式并不一致。具体来说,在老年小鼠中,经典的Pdgfa和Pdgfb低表达,而Pdgfc和Pdgfd表达较高;在肺纤维化的模型中,则只有PDGF-C蛋白表达显著升高。要知道,在不同年龄的人类肺组织中,PDGF-C也呈现出类似的表达模式。
年轻(左)与老年(右)小鼠PDGF家族基因表达水平
除了在肺部具有年龄相关的表达差异之外,Pdgfc在肿瘤细胞中的表达水平也不是一成不变的。虽然体外培养的ER阳性乳腺癌细胞系Pdgfc表达水平很低,但从体内直接分离出的ER阳性乳腺癌细胞却高表达Pdgfc。并且,在老年小鼠肿瘤模型的肺部转移灶中,Pdgfc表达水平也比年轻小鼠肺部的DTCs更高。
无论是从微环境还是从肿瘤自身来看,PDGF-C都可能与ER阳性乳腺癌转移性复发脱不了干系!
那么PGDF-C究竟对肿瘤和微环境分别有什么影响呢?原来,肿瘤细胞自身的Pdgfc表达主要促进DTCs在肺部形成更多散在的小细胞团,对原发灶和转移部位的肿瘤体积影响不大。换言之,只能让肿瘤散若满天“星”,却聚不成一团“火”。光想靠肿瘤自身实现复发,也没那么容易。
其实,动物体内表达PDGF-C受体的主力是成纤维细胞,它们才是复发过程中PDGF-C的主要目标。研究人员发现,PDGF-C可以促进成纤维细胞增殖与迁移,并且有助于成纤维细胞激活、向病灶处聚集。当肺组织向着纤维化的方向发展,DTCs增殖和肿瘤复发不过就是顺水推舟的事了。
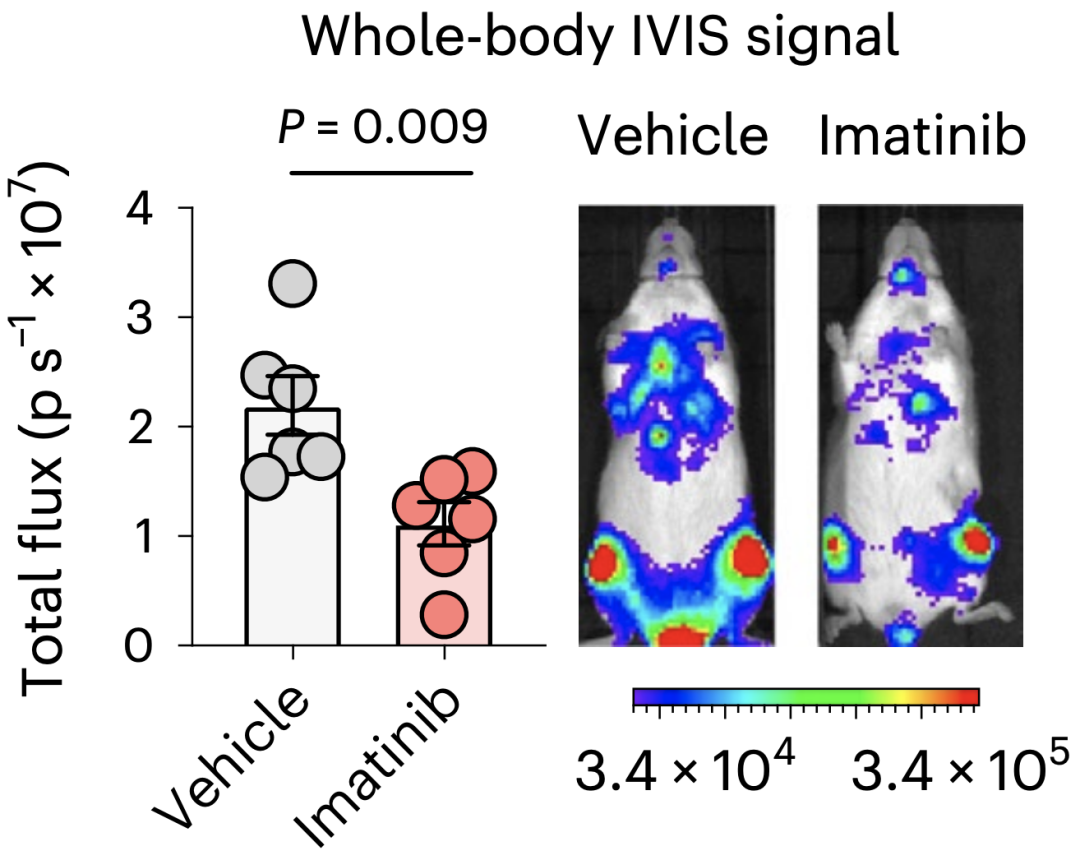
到这里,PDGF-C“助纣为虐”的角色基本确定了,但同时它也可能成为有效阻断转移性复发的靶点。Isacke团队发现,PDGF受体抑制剂伊马替尼可抑制肿瘤相关成纤维细胞(CAF)的活性,并且使转移灶的体积与数量均减少。
伊马替尼可缩小转移病灶
肿瘤复发对于患者及其家庭而言,无疑是一记沉重的打击。本研究不仅提出了ER阳性乳腺癌转移性复发的新机制,也进一步确认了年龄带来的复发风险。未来,靶向PDGF-C的药物若能成功应用于临床,或许将有助于减缓ER阳性乳腺癌的肺部进展,造福更多患者。
参考文献:
[1] Pedersen RN, Esen BÖ, Mellemkjær L, et al. The Incidence of Breast Cancer Recurrence 10-32 Years After Primary Diagnosis. J Natl Cancer Inst. 2022;114(3):391-399. doi:10.1093/jnci/djab202
[2] Ribelles N, Perez-Villa L, Jerez JM, et al. Pattern of recurrence of early breast cancer is different according to intrinsic subtype and proliferation index. Breast Cancer Res. 2013;15(5):R98. doi:10.1186/bcr3559
[3] Pan H, Gray R, Braybrooke J, et al. 20-Year Risks of Breast-Cancer Recurrence after Stopping Endocrine Therapy at 5 Years. N Engl J Med. 2017;377(19):1836-1846. doi:10.1056/NEJMoa1701830
[4] Turrell FK, Orha R, Guppy NJ, et al. Age-associated microenvironmental changes highlight the role of PDGF-C in ER+ breast cancer metastatic relapse. Nat Cancer. 2023;10.1038/s43018-023-00525-y. doi:10.1038/s43018-023-00525-y

本文地址://www.styjt.com/jiankang/2023-04-19/637923.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- XBB.1.16更容易侵袭儿童,引发“红眼病”?2023-04-20 12:00:04
- 让脑出血风险增44%的晚餐习惯,是时候改改了2023-04-20 12:00:02
- 北京大学人民医院神经内科罕见病系列报导之三—— 北京大学人民医院首例患者接受伊奈利珠单抗治疗视神经脊髓炎(NMOSD)2023-04-20 11:27:23
- 当天种牙当天用! 5月8日,德中口腔这场盛会别错过2023-04-20 10:59:33
- 敏感人群注意!北京杨柳飞絮第二个高发期来临 六环内高发时间持续至5月3日!2023-04-20 10:48:55

 70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗
70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗2022-11-07

 梅婷现任70岁老公曾剑个人资料(曾剑个人资料)
梅婷现任70岁老公曾剑个人资料(曾剑个人资料)2022-09-08
- 烟台今天已封闭的小区 烟台现在封闭小区名单有哪些
2022-10-12 09:07:30
- 张家界桑植新娘吴梅婚纱照事件完整版 看女主出轨聊天内容视频
2022-11-11 14:27:00
- 无人售货机功能(无人自动售货机操作方法介绍)
2022-07-27 08:41:09
- 目前南岸区及江北封闭小区名单有哪些 看最新封控通告
2022-11-11 14:49:26
- 2022南宁封控小区名单表 南宁最新封闭小区名单2022年8月什么情况
2022-08-26 09:52:30
文章排行榜
- 周排名
- 月排名
- 1关爱血友病儿,健康茁壮成长—— 复旦大学附属儿科医院2023年世界血友病日暨血友病俱乐部活动顺利举行
- 2预防治疗 人人可及 ——2023年云南省世界血友病日纪念活动圆满落幕
- 3李红蓉教授:通络养生八字经为慢病防治开辟新途径!
- 4应对变异、广谱多价,专家共话新冠病毒疫苗研发新进展
- 52023“创•在上海”国际创新创业生物医药专题赛——上海(南翔)医学产业园分赛点圆满收官
- 6中国民族卫生协会重症代谢疾病分会“痛风基层慢病医联体临床培训中心”项目在江苏昆山启动
- 7比利时专家发文引用中国楚雄州医院骨二科科研成果
- 8AI+游戏即将迎来新浪潮?超参数科技发布GAEA技术系统,能让NPC自己过日子
- 9元一生物与国药太极达成合作|实现生物药领域优势互补
- 10“汇智·聚融·谋远” 赛赋医药创新药物研发生态圈论坛北京站圆满召开