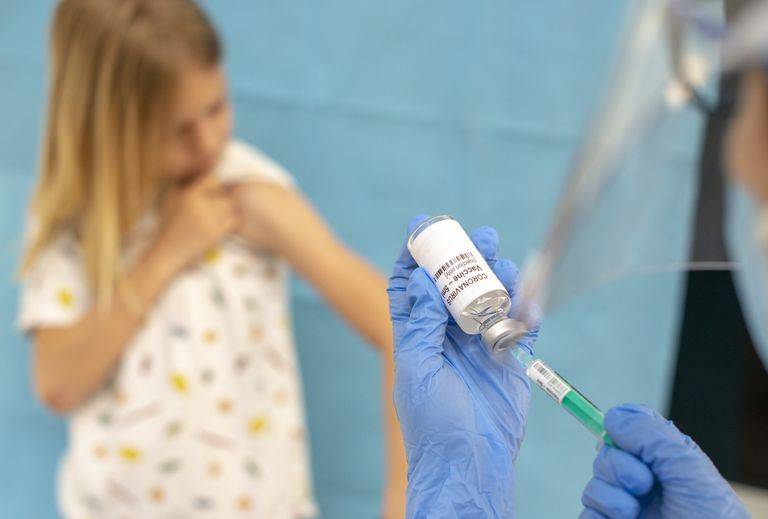
为何新冠疫苗还不能给12岁以下儿童接种?FDA:在等试验数据
- 2021-09-06 08:37:39 就医网
- 半岛电子下载入口
出品 | 搜狐健康
作者 | 周亦川
编辑 | 吴施楠
美国儿童新冠病毒感染程度日趋恶化,近一周新冠感染者中,儿童感染者占比已达到25%。随着越来越多的未接种疫苗的儿童重返校园,父母的焦虑程度与日俱增:病毒正在“寻找”每一个未接种疫苗的人,为什么政府不开放对12岁以下儿童接种疫苗?
目前,辉瑞预计在9月向FDA提交新冠疫苗5—11岁儿童临床数据,可能最早于10月提交紧急使用申请,在秋末或初冬向儿童提供疫苗。Moderna可能比辉瑞晚几个月,而强生则预计在秋季启动儿童试验。著名传染病学家福奇博士、CDC主任Rochelle Walensky等多名专家表示,政府十分关注此事,但要等到FDA批准才能向儿童开放接种。
已有数亿的成年人接种了疫苗,可以证明疫苗的安全有效性,为什么儿童疫苗使用许可的批准还需要这么长时间?
FDA 疫苗和相关生物产品咨询委员会的成员Stanley Perlman 博士解释,对于年幼的儿童,我们必须要花更多的时间确保科学严谨。
任何疫苗的上市都需要在通过成人临床试验之后,才会开始对儿童进行评估。儿童新冠疫苗试验与其他药物的临床试验原则一致,即“儿童不是小号的大人”。他们的身体正在发育,对于疫苗可能产生不同的反应,安全性与耐受性与成人不同,专家需要测试对儿童应用安全且产生有效反应的剂量。
就目前来看,儿童有着非常活跃和灵敏的免疫系统,较小剂量就可以引发充分的免疫反应。在疫苗安全性研究当中,今年6月有研究显示mRNA新冠疫苗与青少年和青年人中极其罕见的心脏炎症反应存在关联。但从当前结果来看,疫苗接种的好处仍然明显大于风险,炎症反应似乎很轻微,可以自行或常规治疗迅速消退。

在未成年人疫苗使用的批准上,FDA使用了成人试验和完整儿童试验的结果。对于12岁以上未成年人,他们的免疫反应与成年人相似,临床试验不必招募成人规模的30000人。对于年幼的儿童,FDA在8月初要求提供6个月的后续安全数据,而不是成年人标准的两个月;同时,FDA还要求辉瑞和Moderna将临床试验中5—11岁儿童受试者的数量增加一倍。
其实,招募儿童受试者并不难,各个试验点都有很长的等候名单,但规模的变化确实让研究时间延长了一个月。规模扩大是值得的,只是为了让试验数据更可靠,为各地的父母提供额外的安全保障。
如果FDA批准辉瑞疫苗上市,CDC 免疫实践咨询委员会将对疫苗做进一步评估,就疫苗的交付、储存、时间安排、分发管理提出建议,最后批准成为正式建议,向儿童开放接种。
在接下来的几个月中,年幼的孩子们还无法得到疫苗的保护。在孩子周围的成年人应全面接种疫苗,并且戴好口罩,避免传染他们。
本文地址://www.styjt.com/kuaixun/2021-09-06/527966.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- 善于“伪装”的脑膜瘤如何察觉?这些早期体育bd 要警惕2021-12-29 10:03:03
- 英研究称,Omicron感染住院风险较Delta低70%2021-12-29 09:57:14
- 美国FDA批准诺华全球首创siRNA降血脂新药上市2021-12-29 09:51:17
- 葵花药业拟引进两款儿童罕见病用药2021-12-29 09:51:04
- 广药集团建成澳门首个GMP标准中成药厂2021-12-29 09:50:49

 什么是阴痛?
什么是阴痛?2021-10-26

 美立方国内外专家齐聚 颌面专家团再升级
美立方国内外专家齐聚 颌面专家团再升级2021-08-23
- 《热点聚焦》医疗机构内新冠病毒感染防控有了新要求
2021-09-15 20:00:10
- 浙大一院2021年中秋节、国庆节放假及工作安排
2021-09-12 14:00:03
- 什么是阴结?
2021-10-26 10:33:42
- 名医风采 美立方颌面国际专家团,轮廓改造天团
2021-08-23 11:48:32
- 12333异地就医备案 您关心的都在这里
2021-09-07 10:40:49