齐鲁制药双抗新药QLS31905 I期研究结果在ESMO免疫肿瘤学大会公布
- 2023-12-12 08:54:26
- 半岛电子下载入口
12月6-8日,欧洲肿瘤内科学会免疫肿瘤学(ESMO Immuno-Oncology)大会在瑞士日内瓦召开,齐鲁制药以壁报形式报告了QLS31905在晚期实体瘤患者中的I期临床试验最新研究结果(壁报编号:132P)。主要研究者为北京大学肿瘤医院的沈琳教授。
QLS31905是由齐鲁制药自主研发的靶向Claudin18.2的双特异性T细胞衔接器(Bispeific T cell Engager)。本研究的主要目的是探索QLS31905在晚期实体瘤患者中安全性、耐受性,以及初步的抗肿瘤活性。
研究背景和设计:
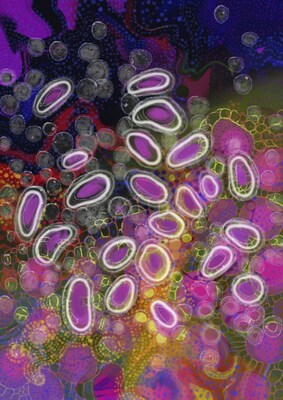
Claudin18.2是具有高度特异性的细胞表面分子,其异常激活表达常见于原发性胃癌以及胰腺癌、食管癌等实体瘤[1],[2]。QLS31905与肿瘤细胞表面的Claudin18.2和T细胞表面的CD3结合,通过募集和激活肿瘤细胞附近的T细胞,对肿瘤细胞进行持续地杀伤裂解。本研究纳入标准治疗失败或不适用或无标准治疗的晚期实体瘤患者。研究分为剂量递增和剂量拓展两个阶段。剂量递增阶段采用加速滴定和i3+3的研究设计,QLS31905单次给药剂量按照0.5μg/kg QW、1.5μg/kg QW、5μg/kg QW、15μg/kg QW、45μg/kg QW、100μg/kg QW、200μg/kg QW、350μg/kg QW、500 μg/kg Q2W递增,主要终点是剂量限制毒性(DLT)和最大耐受剂量(MTD),次要终点是安全性、药代动力学和药效动力学、免疫原性。剂量拓展阶段的主要终点是客观缓解率(ORR),次要终点是疾病控制率(DCR)、无进展生存期(PFS)、总体生存期(OS)。
研究结果:
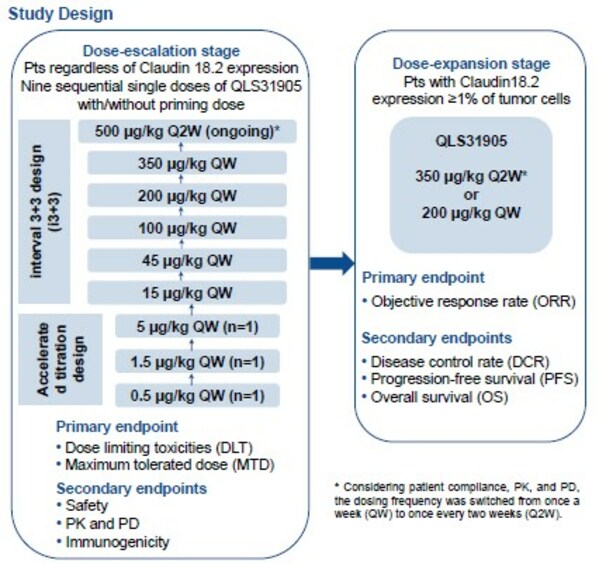
截止2023年7月17日,共计纳入52例受试者,包括31例胃癌和12例胰腺癌患者。剂量递增阶段,共计22例受试者从0.5μg/kg QW爬坡到350 μg/kg QW队列,目前500 μg/kg Q2W剂量水平正在进行中。剂量拓展阶段采用了200μg/kg QW和350μg/kg Q2W两个剂量水平,共计纳入30例受试者。
安全性方面,DLT未发生,尚未确定MTD。共计21例(40.4%)受试者发生了≥3级的治疗相关不良事件(TRAE)。10例(19.2%)受试者发生了治疗相关的严重不良事件。2例受试者(3.8%)发生了导致停止治疗的TRAE。最常见的TRAE是发热(30例,57.7%)、恶心(26例,50.0%)、白细胞计数降低(18例,34.6%)。350 μg/kg QW队列中的2例患者发生3级及以上的细胞因子释放综合征。

疗效方面,在疗效可评价的27例受试者中,ORR为11.1%,DCR为63.0%。达到部分缓解(PR)的3例患者中,2例为胰腺癌,1例为胆囊癌,Claudin18.2表达水平均为中/高表达。在14例疾病稳定(SD)的患者中,8例靶病灶缩小,其中7例为Claudin18.2中/高表达。
综上,QLS31905在晚期实体瘤患者中展现出良好的安全性、耐受性、以及初步的抗肿瘤活性。目前QLS31905的II期临床试验正在进行中。
【参考文献】
1. Sahin U, et al. Clin Cancer Res. 2008;14(23):7624-34. |
2. Singh P, et al. J Hematol Oncol. 2017;10(1):105. |
本文地址://www.styjt.com/kuaixun/2023-12-12/664643.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- 上一篇:中国专家携全球首创中国心脏瓣膜技术,开启一带一路医学交流新篇章
- 下一篇:返回列表
- 齐鲁制药双抗新药QLS31905 I期研究结果在ESMO免疫肿瘤学大会公布2023-12-12 08:54:26
- 中国专家携全球首创中国心脏瓣膜技术,开启一带一路医学交流新篇章2023-12-12 08:53:58
- 安泰康赛宣布突破性发现-MYC合成致死抗肿瘤候选药物JMBI-0012023-12-12 08:53:19
- 童心有梦 成长无忧,上海百汇医院儿童健康管理中心扬帆起航2023-12-12 08:51:17
- 京津冀(德州)医药及健康产业高质量发展大会成功举办2023-12-11 17:00:49

 国家食品药品监督管理局查询入口
国家食品药品监督管理局查询入口2023-05-11

 中国四大顶级医院
中国四大顶级医院2023-09-13
- 70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗
2022-11-07 17:44:38
- 十大不建议买的纯牛奶排行,不能喝牛奶的原因
2023-06-30 14:06:52
- 梅婷现任70岁老公曾剑个人资料(曾剑个人资料)
2022-09-08 09:22:36
- 烟台今天已封闭的小区 烟台现在封闭小区名单有哪些
2022-10-12 09:07:30
- 张家界桑植新娘吴梅婚纱照事件完整版 看女主出轨聊天内容视频
2022-11-11 14:27:00
文章排行榜
- 周排名
- 月排名
- 1京东健康线上首发辉瑞斑秃治疗新药乐复诺® 提升重度斑秃患者用药可及性
- 2上海交通大学医学院附属仁济医院成功举办2023年度尿路修复重建培训班
- 3国内首个获批的国产银屑病靶向口服药欧必达在京东健康线上首发 为患者提供治疗新选择
- 4挑战生命长度,中医药抗衰老研究取得重大进展 ——“第二届中医药抗衰老大会暨世界中医药学会联合会络病专业委员会换届会议”举行
- 5京东健康线上首发辉瑞斑秃治疗新药乐复诺 提升重度斑秃患者用药可及性
- 6陈玉善:冬季心梗高发季 认识心梗的体育bd 及疗法
- 7四川省卫健委印发《四川省互联网总医院建设方案》
- 8吕奔任中南大学湘雅二医院党委副书记、院长
- 9北京:举报违法违规使用医保基金 最高奖励标准提高至20万元
- 10医药智造 共筑未来,润和软件主办科技创新优势推动医药产业高质量发展论坛